Введение
Сублимационная сушка (лиофилизация) - это метод, широко используемый в фармацевтических технологиях для преобразования термолабильных веществ, таких как белки или липосомы, без термической обработки в пригодные для использования и хранения формы. Цель лиофилизации - мягкое удаление воды из растворов для получения стабильного порошка с определенной остаточной влажностью и пористостью.
Состав продукта оказывает решающее влияние на параметры процесса, а значит, и на вид, качество и стабильность получаемого лиофилизата. Динамическая сканирующая калориметрия (ДСК) предоставляет важную информацию для selectи выбора подходящих условий.
Лиофилизируемые растворы обычно представляют собой сложные многокомпонентные системы, состоящие из активных ингредиентов, вспомогательных веществ и воды. Вспомогательные вещества включают тонизирующие соли (для регулировки изотоничности), буферные вещества, криопротекторы (для защиты от повреждений при замораживании) и строительные компоненты, придающие структуру сублимированному продукту. Сахара, такие как сахароза или трегалоза, доказали свою эффективность в стабилизации белков [5]. Следующие соображения основаны на сахарозе как модельном веществе. Упомянутые растворы были получены из коммерчески доступной сахарозы фармацевтического качества (Caesar & Loretz, Hilden) и дважды дистиллированной воды.
Процесс лиофилизации, как правило, можно разделить на 3 последовательных этапа:
Глубокая заморозка
Растворы сахарозы склонны к перенасыщению. При охлаждении образуется лед и все более вязкий раствор сахарозы. Увеличение вязкости затрудняет диффузионные процессы, необходимые для кристаллизации. В результате система не кристаллизуется, а застывает как переохлажденная жидкость без полного разделения фаз (стекло). Температура стеклования максимально концентрированного раствора обозначается Tg' и зависит от конкретного вещества [3].
При охлаждении часто наблюдается переохлаждение. Фармацевтические растворы для парентерального применения (введение через желудочно-кишечный тракт), которые не должны содержать частиц, представляют собой крайний случай. В них практически отсутствуют гетерогенные примеси, которые могли бы служить ядрами кристаллизации. Поэтому зарождение кристаллов в таких растворах зачастую возможно только при температуре, приближающейся к -40°C.
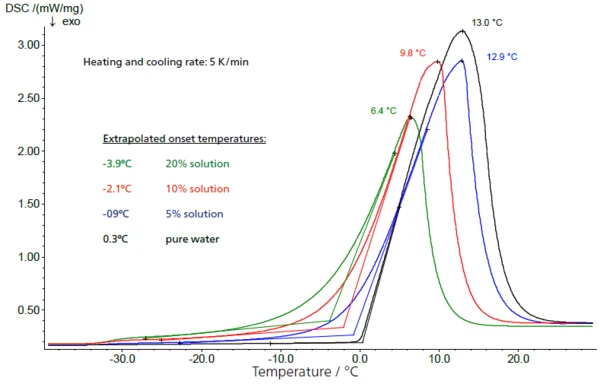
Поведение при замораживании 10 %-ного раствора сахарозы показано на рисунке 2. Образец охлаждался с помощью NETZSCH DSC 204 F1 (см. рис. 1) в закрытом алюминиевом тигле при контролируемой скорости охлаждения 5 К/мин. Переохлажденный раствор чрезвычайно быстро затвердевает при -20°C (экстраполированная температура начала замерзания).

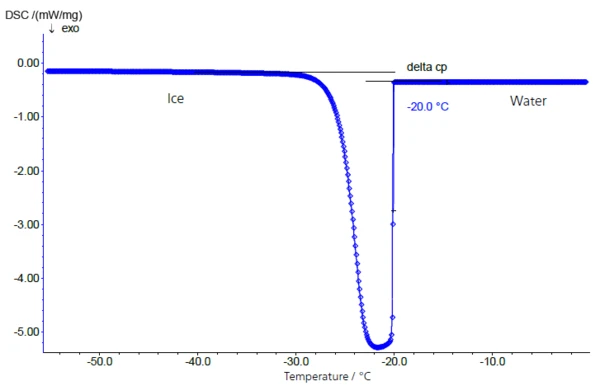
В качестве затравочных кристаллов могут выступать шероховатостиots на внутренней поверхности тигля или следы загрязнения при подготовке. По этой причине температуры застывания, определенные таким образом, как правило, не могут быть соотнесены с концентрацией используемых сахарных растворов.
При переходе воды в лед происходит изменение удельной теплоемкости с 4,18 Дж/г-К (вода) до 2,1 Дж/г-К (лед, чуть ниже точки замерзания), что в первую очередь обуславливает четкое смещение базовой линии до и после пика застывания/плавления (рис. 2: переход воды в лед - и рис. 3: переход льда в воду).
При последующем нагреве со скоростью 5 К/мин (рис. 3) стеклование максимально концентрированного раствора происходит при -32°C (средняя точка). Это значение хорошо согласуется с литературными данными, предполагающими -32°C и -33°C [2], [4].
За стеклованием следует эндотермический пик при нагревании (вставка на рисунке 3), экстраполированная температура начала которого, Tm´, описывает начало плавления льда. Согласно Роосу [1], максимальная "концентрация замерзания" может наблюдаться только при температурах замерзания между Tg´и Tm´.
Область ниже пика плавления соответствует свободной части воды. Точкой отсчета здесь является теплота плавления льда, равная 333,7 Дж/г.
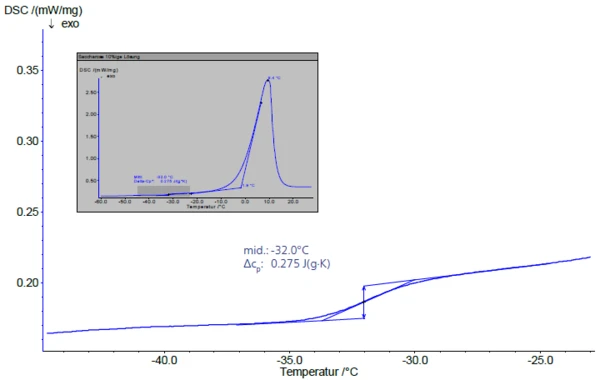
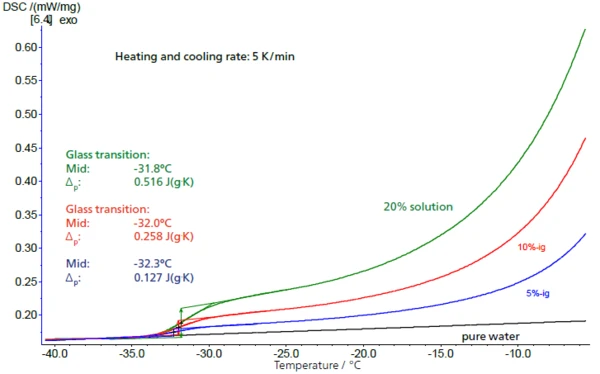
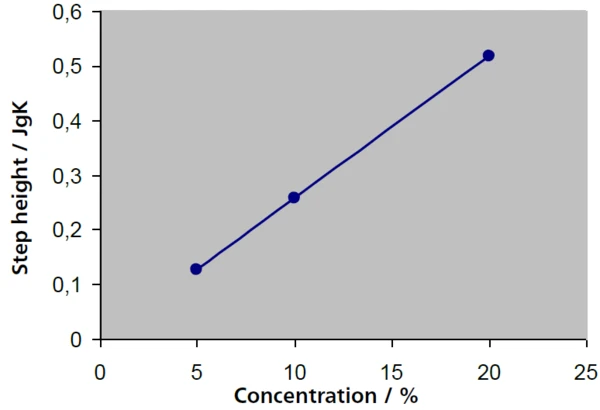
В низкоконцентрированных растворах доля сахарозы может быть определена по высоте соответствующего стеклования. На рисунке 4 показано, что высота ступеньки (значения ΔУдельная теплоемкость (cp)Теплоемкость - это специфическая для каждого материала физическая величина, определяемая количеством тепла, подведенного к образцу, деленным на полученное повышение температуры. Удельная теплоемкость относится к единице массы образца.cp) для растворов 5%, 10% и 20% - с результатами 0,127 Дж/г-К, 0,258 Дж/г-К и 0,516 Дж/г-К - очень хорошо согласуется с масштабированием концентрации в 2 раза, при этом температуры стеклования остаются largeли постоянными. Существует линейная зависимость между высотой ступеньки и концентрацией (рис. 5).
Кроме того, с увеличением концентрации растворов сахарозы начало плавления льда (экстраполированная температура начала плавления) смещается к более низким значениям на рисунке 6. При более высоких концентрациях это приводит к уменьшению интервала между стеклованием максимально концентрированного раствора и началом плавления свободной воды.
Некоторые аморфные вещества вновь кристаллизуются при нагревании выше температуры стеклования. Этот эффект, называемый девитрификацией или холодной кристаллизацией, можно использовать для изменения пористости и остаточной влажности лиофилизата [2] путем закалки материала выше температуры рекристаллизации (экстраполированного начала). В результате рекристаллизации происходит разделение фаз, и высвобожденная "незамороженная" вода превращается в лед. Однако, как показано на рисунке 3, в случае сахарозы посткристаллизации не происходит.
Первичная сушка
На этом этапе замороженный лед удаляется в вакууме путем сублимации (перехода из твердого в газообразное агрегатное состояние).
Во время этого процесса - при котором тепло подводится извне - температура в продукте не должна подниматься выше температуры стеклования, так как это приводит к размягчению каркасной структуры и разрушению системы [5]. Разрушение каркасной структуры во время фазы сушки называется коллапсом.
Хотя температуры коллапса, по некоторым данным, в среднем на 1-5 К выше соответствующих температур стеклования [6], хорошие ориентиры для их определения - температуры стеклования максимально концентрированных растворов, Tg´, которые могут быть определены с помощью ДСК.
Вторичная сушка
На этом этапе продукт высушивается до желаемого конечного уровня влажности путем десорбции воды, содержащейся в матрице, при медленном повышении температуры.
В аморфных лиофилизатах вода должна диффундировать из стеклообразной фазы на поверхность. Этот довольно медленный процесс является причиной того, что этап после сушки часто определяет скорость сублимационной сушки для аморфных лиофилизатов [2].
Из-за смягчающего эффекта воды температура стеклования аморфной фазы напрямую зависит от содержания в ней воды. По мере обезвоживания Tg (температура стеклования сахарозы как твердого вещества) повышается; ее положение также можно быстро и точно определить с помощью ДСК.
Заключение
Важными характеристиками для проектирования процесса первичной сушки являются температура стеклования максимально концентрированного раствора (Tg´) и температура коллапса, при которой материал размягчается настолько, что больше не может поддерживать свою собственную структуру и начинает течь. С помощью ДСК (иногда ТМ-ДСК*) можно легко определить Tg´.
Температура коллапса немного выше, чем Tg´; точный интервал между Tg´и температурой коллапса зависит от рецептуры.