Einleitung
Gefriertrocknung (Lyophilisation) ist ein in der pharmazeutischen Technologie weit verbreitetes Verfahren, um z.B. thermolabile Stoffe wie Proteine oder Liposome – ohne thermische Behandlung – in gebrauchs- und lagerfähige Formen zu überführen. Ziel der Lyophilisation ist die schonende Entfernung von Wasser aus Lösungen und die Gewinnung eines stabilen Pulvers definierter Restfeuchte und Porosität.
Die Produktzusammensetzung hat einen entscheidenden Einfluss auf die Prozessparameter und wirkt sich so auch auf Art, Qualität und Stabilität des entstehenden Lyophilisats aus. Die Dynamische Differenzkalorimetrie (DDK oder englisch DSC) liefert wichtige Hinweise zur Auswahl geeigneter Bedingungen.
Bei den zu lyophilisierenden Lösungen handelt es sich meist um komplexe Mehrstoffsysteme, bestehend aus Wirkstoffen, Hilfsstoffen und Wasser. Zu den Hilfsstoffen zählen Tonisierungssalze (zur Einstellung der Isotonie), Puffersubstanzen, Cryoprotektoren (zum Schutz vor Schädigungen beim Einfrieren) und Gerüststoffe, die dem gefriergetrockneten Produkt Struktur geben. Zur Stabilisierung von Proteinen haben sich Zucker, wie Saccharose oder Trehalose als sehr effektiv erwiesen [5]. Die nachfolgenden Betrachtungen bauen auf Saccharose als Modellsubstanz auf. Die angesprochenen Lösungen wurden aus handelsüblicher Saccharose in pharmazeutischer Qualität (Fa. Caesar & Loretz, Hilden) und bidestilliertem Wasser hergestellt.
Der Lyophilisationsprozess lässt sich in drei aufeinanderfolgende Schritte unterteilen:
Einfrieren
Zuckerlösungen neigen zur Übersättigung. Beim Abkühlen bilden sich Eis und eine immer viskosere Saccharoselösung. Durch die zunehmende Viskosität werden Diffusionsvorgänge, die für eine KristallisationAls Kristallisation bezeichnet man den physikalischen Vorgang der Verhärtung bei der Bildung und beim Wachstum von Kristallen. Bei diesem Prozess wird Kristallisationswärme frei.Kristallisation notwendig wären, erschwert. Als Folge davon kristallisiert das System nicht aus, sondern erstarrt als unterkühlte Flüssigkeit ohne vollständige Phasentrennung (Glas). Die Glasumwandlungstemperatur der maximal konzentrierten Lösung wird als Tg’ bezeichnet und ist stoffspezifisch [3].
Häufig ist beim Abkühlen Unterkühlung zu beobachten. Einen Extremfall stellen dabei pharmazeutische Lösungen zur parenteralen Applikation (Verabreichung unter Umgehung des Magen-Darm-Traktes) dar. Sie müssen partikelfrei sein und besitzen demnach so gut wie keine heterogenen Verunreinigungen, die als Kristallisationskeime wirken könnten. Daher wird eine Kristallkeimbildung in solchen Lösungen oft erst nahe -40°C wahrscheinlich.
Das Einfrierverhalten einer 10%-igen Saccharoselösung zeigt Abbildung 2. Die Probe wurde in einem geschlossenen Aluminiumtiegel in einer NETZSCH DSC 204 F1 (siehe Abbildung 1) mit 5 K/min geregelt abgekühlt. Die unterkühlte Lösung erstarrt bei -20°C (extrapolierte Onsettemperatur) extrem rasch.

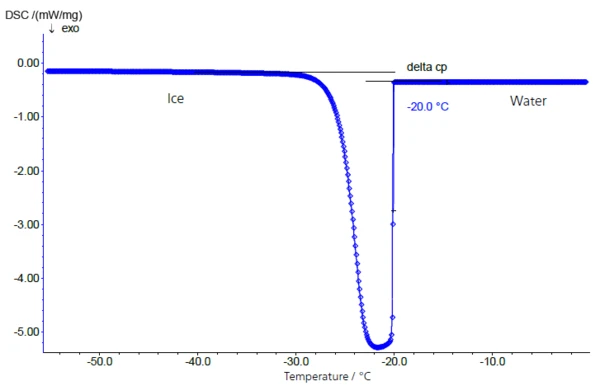
Raue Stellen an der Innenseite der Tiegel oder durch die Präparation eingebrachte Verunreinigungsspuren können als Kristallisationskeime wirken. Aus diesem Grund lassen sich so ermittelte Erstarrungstemperaturen in der Regel nicht mit den Konzentrationen der verwendeten Zuckerlösungen korrelieren.
Während des Übergangs Wasser/Eis tritt eine Änderung der spezifischen Wärme von 4,18 J/g·K (Wasser) auf 2,1 J/g·K (Eis, knapp unterhalb des Gefrierpunktes) auf, die hauptsächlich für den deutlichen Versatz der Basislinie vor und nach dem Erstarrungs-/Schmelzpeak verantwortlich ist (Abbildung 2: Übergang Wasser-Eis und Abbildung 3: Übergang Eis-Wasser).
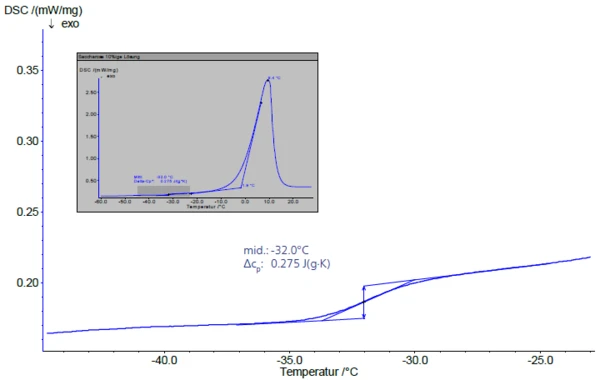
In der nachfolgenden Aufheizung mit einer Heizrate von 5 K/min (Abbildung 3) zeigt sich der Glasübergang der maximal konzentrierten Lösung bei -32°C (Midpoint). Dieser Wert stimmt gut mit den Literaturdaten überein, die von -32 °C bzw. -33 °C ausgehen [2], [4].
Dem Glasübergang schließt sich ein endothermer Peak an (Abbildung 3, kleines Bild), dessen extrapolierte Onsettemperatur Tm´ den Beginn der Eisschmalze beschreibt. Nach Roos [1] kann die maximal “Gefrierkonzentration” nur bei Einfriertemperaturen zwischen Tg´ und Tm´ beobachtet werden.
Die Fläche unter dem Schmelzpunkt entspricht dem Anteil des freien Wassers. Der Bezugspunkt ist dabei die Schmelzwärme des Eises von 333,7 J/g.
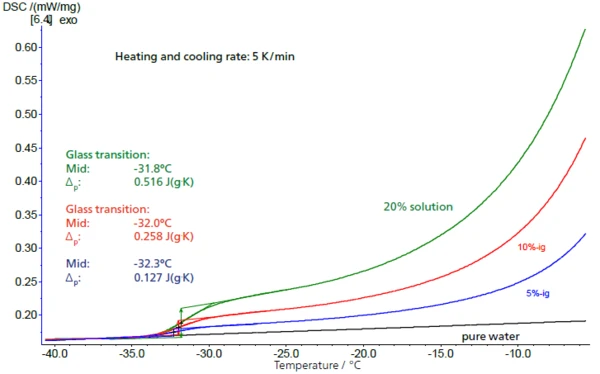
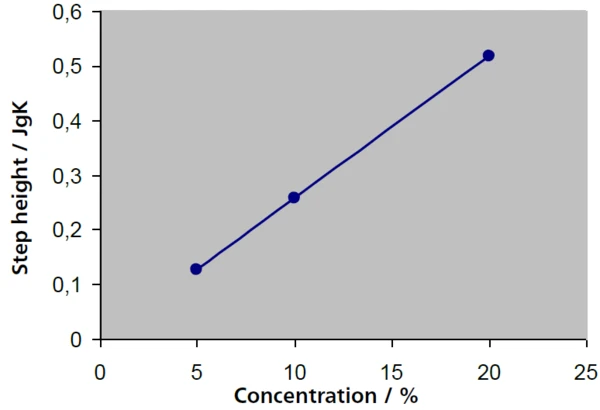
In gering konzentrierten Lösungen lässt sich der Saccharose-Anteil aus der Höhe des jeweiligen Glasübergangs erschließen. In Abbildung 4 stimmen die Stufenhöhen (Δcp-Werte) bei 5 %-, 10 %- und 20 %-igen Lösungen mit Ergebnisse von 0,127 J/g·K, 0,258 J/g·K sowie 0,516 J/g·K mit der Staffelung der Konzentration um den Faktor 2 sehr gut überein, während die comGlasumwandlungstemperaturen weitgehend konstant bleiben. Es ergibt sich ein linearer Zusammenhang zwischen Stufenhöhe und Konzentration (Abbildung 5).
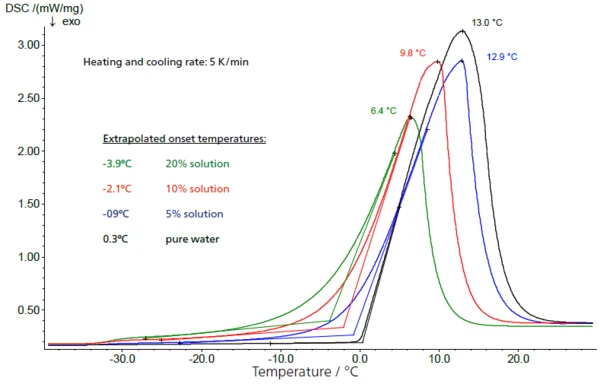
Zusätzlich verschiebt sich mit zunehmender Konzentration der Saccharoselösungen in Abbildung 6 der Beginn der Eisschmelze (extrapolierte Onsettemperatur) zu niedrigeren Werten. Es kommt bei höheren Konzentrationen dadurch zu einem geringeren Abstand zwischen dem Glasübergang der maximal konzentrierten Lösung und dem Beginn des Aufschmelzens des freien Wassers.
Manche amorphe Stoffe kristallisieren beim Aufheizen über die Glastemperatur hinweg wieder aus. Dieser Effekt, der Entglasung, Devitrifizierung oder Nachkristallisation (Kaltkristallisation)Bei der Nachkristallisation handelt es sich um eine Veränderung der physikalischen Struktur, die zur Erhöhung des Kristallisationsgrades und der Lamellendicke sowie zur Vervollkommnung der Kristallstruktur führt.Kaltkristallisation genannt wird, kann ausgenutzt werden, um durch Tempern des Materials oberhalb der Rekristallisationstemperatur (extrapolierter Onset) die Porosität und Restfeuchte des Lyophilisats zu verändern [2]. Durch die Rekristallisation tritt eine Phasentrennung auf und das frei gewordene „unausgefrorene“ Wasser wird zu Eis. Wie Abbildung 3 zeigt, tritt im Fall von Saccharose jedoch keine Nachkristallisation auf.
Erster Trocknungsprozess
In diesem Schritt wird das gefrorene Eis durch Sublimation (Übergang vom festen in den gasförmigen Aggregatzustand) im Vakuum entfernt.
Während dieses Prozesses – bei dem Wärme von außen zugeführt wird – sollte die Temperatur im Produkt nicht über die Temperatur des Glasübergangs hinaus ansteigen, da dies zu einer Erweichung der Gerüststruktur und zur Kollabierung des Systems führt [5]. Als Kollaps wird die Zerstörung der Gerüststruktur während der Trocknungsphase bezeichnet. Obwohl von Kollapstemperaturen berichtet wird, die im Mittel 1 bis 5 K über den dazugehörigen Glasumwandlungstemperaturen liegen [6], sind die über DSC ermittelbaren Glasumwandlungen der maximal konzentrierten Lösungen Tg´ gute Anhaltspunkte für deren Lage.
Zweiter Trocknungsprozess
In diesem Schritt wird das Produkt auf die gewünschte Endfeuchte getrocknet, indem durch langsame Temperaturerhöhung das in der Matrix eingeschlossene Wasser desorbiert.
Bei amorphen Lyophilisaten muss das Wasser dazu aus der Glasphase an die Oberfläche diffundieren. Dieser recht langsame Prozess führt dazu, dass die Nachtrocknung von amorphen Lyophilisaten oftmals der geschwindigkeitsbestimmende Schritt der Gefriertrocknung ist [2].
Aufgrund des Weichmachereffektes von Wasser steht die GlasübergangstemperaturDer Glasübergang gilt als eine der wichtigsten Eigenschaften amorpher und teilkristalliner Materialien, wie z.B. anorganische Gläser, amorphe Metalle, Polymere, Pharmazeutika und Lebensmittel, usw., und bezeichnet den Temperaturbereich, in dem sich die mechanischen Eigenschaften des Material von einem harten und spröden Zustand in einen weicheren, verformbaren oder gummiartigen Zustand ändern.Glasübergangstemperatur der amorphen Phase direkt mit dem Gehalt des eingeschlossenen Wassers in Beziehung. Während der fortschreitenden Entwässerung kommt es zu einem Anstieg des Tg (dem Glasübergang der Saccharose als Feststoff), dessen Lage ebenfalls schnell und präzise mit DSC bestimmt werden kann.
Zusammenfassung
Wesentliche Merkmale für die Erstellung des ersten Trocknungsprozesses sind die GlasübergangstemperaturDer Glasübergang gilt als eine der wichtigsten Eigenschaften amorpher und teilkristalliner Materialien, wie z.B. anorganische Gläser, amorphe Metalle, Polymere, Pharmazeutika und Lebensmittel, usw., und bezeichnet den Temperaturbereich, in dem sich die mechanischen Eigenschaften des Material von einem harten und spröden Zustand in einen weicheren, verformbaren oder gummiartigen Zustand ändern.Glasübergangstemperatur der maximal konzentrierten Lösung (Tg´) und die Kollapstemperatur, bei der das Material so weich wird, dass es seine eigene Struktur nicht mehr tragen kann und zu fließen beginnt. Mit Hilfe der DSC (in manchen Fällen auch TM-DSC*) kann Tg´ einfach bestimmt werden. Die Kollapstemperatur liegt etwas höher als Tg´; das exakte Intervall zwischen Tg´ und der Kollapstemperatur hängt von der Formulierung ab.
*Temperaturmodulierte DSC