Introduzione
La liofilizzazione (lyophilization) è una tecnica ampiamente utilizzata nelle tecnologie farmaceutiche per trasformare sostanze termolabili come proteine o liposomi - senza trattamento termico - in forme utilizzabili e conservabili. L'obiettivo della liofilizzazione è la rimozione delicata dell'acqua dalle soluzioni per ottenere una polvere stabile con umidità residua e porosità definite.
La composizione di un prodotto ha un'influenza decisiva sui parametri del processo e quindi anche sul tipo, sulla qualità e sulla stabilità del liofilizzato ottenuto. La calorimetria dinamica a scansione (DSC) fornisce informazioni importanti per la selectione delle condizioni appropriate.
Le soluzioni da liofilizzare sono di solito sistemi complessi multicomponenti costituiti da principi attivi, additivi e acqua. Gli ausiliari comprendono sali tonificanti (per la regolazione dell'isotonicità), sostanze tampone, crioprotettori (per la protezione contro i danni durante il congelamento) e costruttori che danno struttura al prodotto liofilizzato. Zuccheri come il saccarosio o il trealosio si sono dimostrati molto efficaci nello stabilizzare le proteine [5]. Le considerazioni che seguono si basano sul saccarosio come sostanza modello. Le soluzioni menzionate sono state prodotte con saccarosio di qualità farmaceutica disponibile in commercio (Caesar & Loretz, Hilden) e acqua bidistillata.
Il processo di liofilizzazione può essere generalmente suddiviso in 3 fasi consecutive:
Congelamento profondo
Le soluzioni zuccherine tendono a saturare eccessivamente. Al raffreddamento si formano ghiaccio e una soluzione di saccarosio sempre più viscosa. L'aumento della viscosità complica i processi di diffusione, che sarebbero necessari per la CristallizzazioneLa cristallizzazione è il processo fisico di indurimento durante la formazione e la crescita dei cristalli. Durante questo processo viene rilasciato il calore di cristallizzazione.cristallizzazione. Di conseguenza, il sistema non cristallizza ma si solidifica come liquido sottoraffreddato senza una completa separazione di fase (vetro). La temperatura di transizione vetrosa della soluzione massimamente concentrata è denominata Tg' ed è specifica della sostanza [3].
Durante il raffreddamento, spesso si osserva un superraffreddamento. Un caso estremo è rappresentato dalle soluzioni farmaceutiche per uso parenterale (che devono essere somministrate evitando il tratto gastrointestinale), che devono essere prive di particelle. Non hanno praticamente impurità eterogenee che potrebbero agire come nuclei di CristallizzazioneLa cristallizzazione è il processo fisico di indurimento durante la formazione e la crescita dei cristalli. Durante questo processo viene rilasciato il calore di cristallizzazione.cristallizzazione. Pertanto, la nucleazione dei cristalli in queste soluzioni è spesso probabile solo quando la temperatura si avvicina a -40°C.
Il comportamento di congelamento di una soluzione di saccarosio al 10% è mostrato nella figura 2. Il campione è stato raffreddato con il sistema . NETZSCH Il campione è stato raffreddato con il DSC 204 F1 (vedi figura 1) in un crogiolo di alluminio chiuso a una velocità di raffreddamento controllata di 5 K/min. La soluzione superraffreddata si solidifica molto rapidamente a -20°C (temperatura di inizio estrapolata).

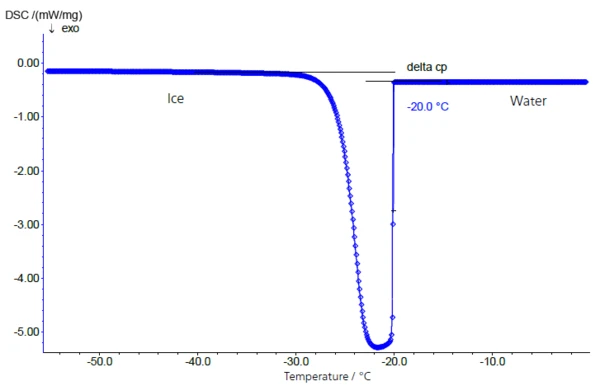
ots I cristalli grezzi presenti all'interno del crogiolo o le tracce di contaminazione causate dalla preparazione possono fungere da cristalli seme. Per questo motivo, le temperature di solidificazione così determinate non sono generalmente correlabili con la concentrazione delle soluzioni zuccherine utilizzate.
Durante la transizione acqua-ghiaccio, si verifica un cambiamento del calore specifico da 4,18 J/g-K (acqua) a 2,1 J/g-K (ghiaccio, appena sotto il punto di congelamento), che è il principale responsabile del chiaro spostamento della linea di base prima e dopo il picco di solidificazione/fusione (figura 2: transizione acqua-ghiaccio - e figura 3: transizione ghiaccio-acqua).
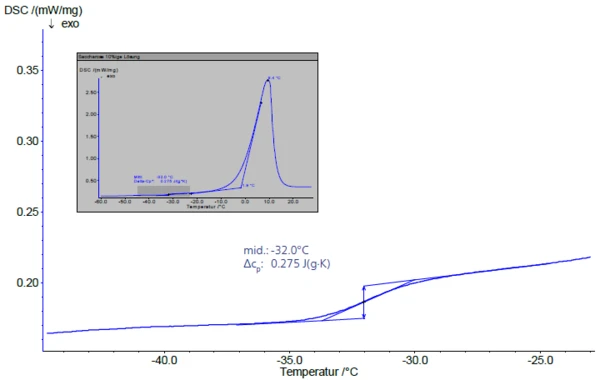
Nel successivo riscaldamento a una velocità di 5 K/min (figura 3), la transizione vetrosa della soluzione massimamente concentrata appare a -32°C (punto medio). Questo valore è in buon accordo con i dati di letteratura che ipotizzano -32°C e -33°C [2], [4].
La transizione vetrosa è seguita da un picco EndotermicoUna transizione campionaria o una reazione è endotermica se per la conversione è necessario il calore.endotermico durante il riscaldamento (figura 3), la cui temperatura di insorgenza estrapolata, Tm´, descrive l'inizio dellaTemperature di fusione ed entalpieL'entalpia di fusione di una sostanza, nota anche come calore latente, è una misura dell'apporto di energia, tipicamente calore, necessario per convertire una sostanza dallo stato solido a quello liquido. Il punto di fusione di una sostanza è la temperatura alla quale essa cambia stato da solido (cristallino) a liquido (fusione isotropa). fusione del ghiaccio. Secondo Roos [1], la massima "concentrazione di congelamento" può essere osservata solo a temperature di congelamento comprese traTg´e Tm´.
L'area al di sotto del picco diTemperature di fusione ed entalpieL'entalpia di fusione di una sostanza, nota anche come calore latente, è una misura dell'apporto di energia, tipicamente calore, necessario per convertire una sostanza dallo stato solido a quello liquido. Il punto di fusione di una sostanza è la temperatura alla quale essa cambia stato da solido (cristallino) a liquido (fusione isotropa). fusione corrisponde alla porzione di acqua libera. Il punto di riferimento in questo caso è il calore diTemperature di fusione ed entalpieL'entalpia di fusione di una sostanza, nota anche come calore latente, è una misura dell'apporto di energia, tipicamente calore, necessario per convertire una sostanza dallo stato solido a quello liquido. Il punto di fusione di una sostanza è la temperatura alla quale essa cambia stato da solido (cristallino) a liquido (fusione isotropa). fusione del ghiaccio, pari a 333,7 J/g.
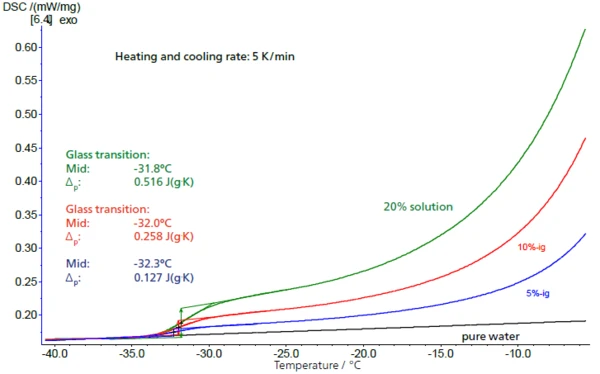
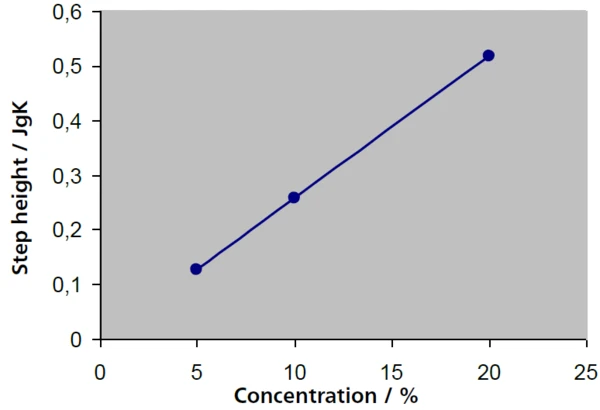
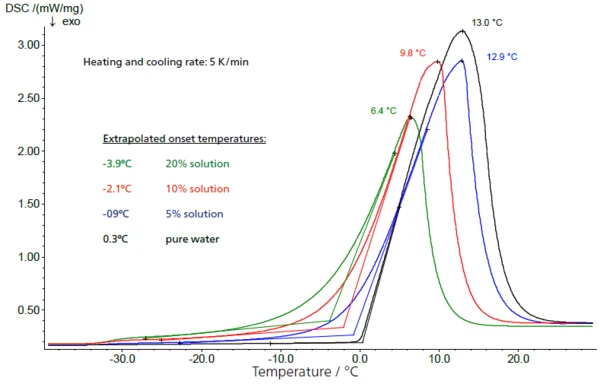
Nelle soluzioni a bassa concentrazione, la proporzione di saccarosio può essere determinata dall'altezza della rispettiva transizione vetrosa. Nella figura 4, le altezze dei gradini (valori di ΔCapacità termica specifica (cp)La capacità termica è una grandezza fisica specifica del materiale, determinata dalla quantità di calore fornita al campione, divisa per l'aumento di temperatura risultante. La capacità termica specifica è correlata all'unità di massa del campione.cp) per soluzioni al 5%, 10% e 20% - con risultati di 0,127 J/g-K, 0,258 J/g-K e 0,516 J/g-K - sono in ottimo accordo con una scalatura della concentrazione di un fattore 2, mentre le temperature di transizione vetrosa rimangono largecostanti. Esiste una relazione lineare tra l'altezza del gradino e la concentrazione (fig. 5).
Inoltre, con l'aumento della concentrazione delle soluzioni di saccarosio, l'inizio dellaTemperature di fusione ed entalpieL'entalpia di fusione di una sostanza, nota anche come calore latente, è una misura dell'apporto di energia, tipicamente calore, necessario per convertire una sostanza dallo stato solido a quello liquido. Il punto di fusione di una sostanza è la temperatura alla quale essa cambia stato da solido (cristallino) a liquido (fusione isotropa). fusione del ghiaccio (temperatura di inizio estrapolata) si sposta verso valori più bassi nella figura 6. A concentrazioni più elevate, ciò si traduce in un intervallo inferiore tra la transizione vetrosa della soluzione massimamente concentrata e l'inizio dellaTemperature di fusione ed entalpieL'entalpia di fusione di una sostanza, nota anche come calore latente, è una misura dell'apporto di energia, tipicamente calore, necessario per convertire una sostanza dallo stato solido a quello liquido. Il punto di fusione di una sostanza è la temperatura alla quale essa cambia stato da solido (cristallino) a liquido (fusione isotropa). fusione dell'acqua libera.
Alcune sostanze amorfe cristallizzano nuovamente quando il riscaldamento supera la temperatura di vetro. Questo effetto, chiamato devitrificazione o CristallizzazioneLa cristallizzazione è il processo fisico di indurimento durante la formazione e la crescita dei cristalli. Durante questo processo viene rilasciato il calore di cristallizzazione.cristallizzazione a freddo, può essere sfruttato per modificare la porosità e l'umidità residua del liofilizzato [2] temperando il materiale al di sopra della temperatura di ricristallizzazione (onset estrapolato). A causa della ricristallizzazione, si verifica una separazione di fase e l'acqua "non congelata" rilasciata si trasforma in ghiaccio. Come mostrato nella figura 3, tuttavia, nel caso del saccarosio non si verifica alcuna post-CristallizzazioneLa cristallizzazione è il processo fisico di indurimento durante la formazione e la crescita dei cristalli. Durante questo processo viene rilasciato il calore di cristallizzazione.cristallizzazione.
Essiccazione primaria
In questa fase, il ghiaccio congelato viene rimosso sotto vuoto per sublimazione (passaggio dallo stato solido a quello gassoso dell'aggregato).
Durante questo processo - in cui il calore viene fornito dall'esterno - la temperatura del prodotto non deve salire al di sopra della temperatura di transizione vetrosa, poiché ciò porta al rammollimento della struttura e al collasso del sistema [5]. La distruzione della struttura portante durante la fase di essiccazione è chiamata collasso.
Sebbene le temperature di collasso riportate siano in media da 1 a 5 K più alte delle corrispondenti temperature di transizione vetrosa [6], le transizioni vetrose delle soluzioni massimamente concentrate,Tg´, che possono essere determinate mediante DSC, sono buoni punti di riferimento per la loro posizione.
Essiccazione secondaria
In questa fase, il prodotto viene essiccato fino al livello di umidità finale desiderato, desorbendo l'acqua contenuta nella matrice attraverso un lento aumento della temperatura.
Nei liofilizzati amorfi, l'acqua deve diffondere dalla fase vetrosa alla superficie. Questo processo piuttosto lento è il motivo per cui la fase di post-essiccazione è spesso quella che determina la velocità di liofilizzazione dei liofilizzati amorfi [2].
A causa dell'effetto ammorbidente dell'acqua, la temperatura di transizione vetrosa della fase amorfa è direttamente correlata al contenuto di acqua intrappolata. Con il progredire della disidratazione, laTg (la transizione vetrosa del saccarosio come solido) aumenta; la sua posizione può anche essere determinata in modo rapido e preciso mediante DSC.
Conclusione
Caratteristiche essenziali per la progettazione del processo di essiccazione primaria sono la temperatura di transizione vetrosa della soluzione massimamente concentrata (Tg´) e la temperatura di collasso alla quale il materiale si ammorbidisce in modo tale da non poter più sostenere la propria struttura e inizia a fluire. Utilizzando il DSC (talvolta chiamato TM-DSC*), laTg´può essere facilmente determinata.
La temperatura di collasso è leggermente superiore allaTg´; l'intervallo esatto tra laTg´e la temperatura di collasso dipende dalla formulazione.