Giriş
Potasyum klavulanat (Şekil 1), Streptomyces clavuligerus organizması tarafından üretilen önemli bir ß-laktam antibiyotik olan klavulanik asidin bir tuzudur [1]. Aslında tek başına çoğu organizmaya karşı zayıf antibakteriyel aktiviteye sahiptir, ancak amoksisilin antibiyotiği ile kombinasyon halinde, tek başına amoksisiline dirençli olan ß-laktamaz üreten stafilokok bakterilerine karşı etkilidir [2, 3]. Bu nedenle ilaç endüstrisinde yerleşik bir maddedir.
Amoksisilin ve potasyum klavulanat benzer bozunma yolları sergiler. Bununla birlikte, amoksisilin-klavulanat kombinasyonunun stabilitesi esas olarak ikisinden daha bozunabilir olan klavulanata bağlıdır [4, 5].
Potasyum klavulanatın ayrışması birçok makalede araştırılmıştır [3, 4, 7, 12]. Genel olarak, madde farklı pH seviyelerine sahip çözeltilerde ve amoksisilin varlığında incelenmiştir. Amoksisilin/klavulanik asit karışımının stabilitesinin 25°C'den 40°C'ye kadar sıcaklık artışından etkilendiği gözlemlenmiştir [3]. Öte yandan, çözeltinin pH'ı asitlendirilirse karışımın raf ömrü önemli ölçüde artmaktadır [4]. Çözeltilerde klavulanik asidin ayrışmasının hidroliz ürünleri tarafından katalize edildiği de gözlemlenmiştir [12]. Farklı sıcaklıklarda ve farklı atmosferik koşullar altında depolanan numuneler üzerinde HPLC yöntemi kullanılarak gösterildiği gibi, potasyum klavulanatın katı halde bozunması başka bir mekanizma izlemektedir: Katı fazda oluşan bozunma ürünlerinin herhangi bir katalitik etkisi yoktur [8].
Termal kararlılık, diğer şeylerin yanı sıra, bir malzemenin ayrışmaya veya reaksiyona girmeye başladığı sıcaklığı belirleyen termogravimetri ile de araştırılabilir [9]. Katı potasyum klavulanatın termal ayrışması, [13]'te bir FT-IR spektrometresine bağlı bir termobalans aracılığıyla karakterize edilmiştir. Aşağıda, Ayrışma reaksiyonuBir ayrışma reaksiyonu, katı ve/veya gaz ürünler oluşturan kimyasal bir bileşiğin termal olarak indüklenen bir reaksiyonudur. ayrışma reaksiyonunun kinetik çalışmalarını yürütmek için termogravimetrik ölçümler kullanılmıştır.
Bu, belirli sıcaklık ve zaman koşulları için potasyum klavulanat bozunmasının tahmin edilmesini sağlar. Termal kararlılığın bilinmesi ve potasyum klavulanatın katı halde bozunma sürecinin anlaşılması, depolama koşullarının optimize edilmesini sağlar.
Deneysel
TGA ölçümleri otomatik numune değiştiricili bir NETZSCH TG 209 F1 Libra® termobalans ile gerçekleştirilmiştir. 13]'te açıklanan TGA-FT-IR ölçümünden, ölçüm başlar başlamaz numunenin yüzey suyunu serbest bıraktığını öğrendik. Bu nedenle, sonraki ölçümler kapalı alüminyum krozeler kullanılarak gerçekleştirilmiştir. Ölçümden hemen önce, kroze kapağı ASC'nin delme cihazı tarafından otomatik olarak delindi. Bu, numunenin gerçek ölçüm başlamadan önce yüzey suyunu serbest bırakmasını önler, bu da başlangıç kütlesinin değerini tahrif eder.
Numune kütleleri 4,33 ila 5,04 mg arasındaydı. Numuneler oda sıcaklığı ile 600°C arasında 1 K/dak ile 10 K/dak arasında değişen dört ısıtma hızında ısıtılmıştır. Ölçümler dinamik bir azot atmosferinde (40 ml/dak) gerçekleştirilmiştir.
Elde edilen TGA eğrileri, Ayrışma reaksiyonuBir ayrışma reaksiyonu, katı ve/veya gaz ürünler oluşturan kimyasal bir bileşiğin termal olarak indüklenen bir reaksiyonudur. ayrışma reaksiyonunun kinetik değerlendirmesi için temel oluşturmaktadır.
Bunun için Kinetics Neo yazılımı ( NETZSCH-Gerätebau GmbH tarafından) kullanılmıştır. Tek ve çok adımlı reaksiyonların kinetiğinin modellenmesine olanak sağlar.
Bu yazılım, her bir adımı aktivasyon enerjisi, reaksiyon sırası ve ön-eksponansiyel faktör gibi kendi kinetik parametrelerine sahip farklı reaksiyon türlerine atayabilir. Sonuçlara dayanarak, Kinetics Neo kullanıcı tarafından belirlenen sıcaklık programları için reaksiyon(lar)ı simüle edebilmektedir.
Sonuçlar ve Tartışma
TGA Ölçümleri
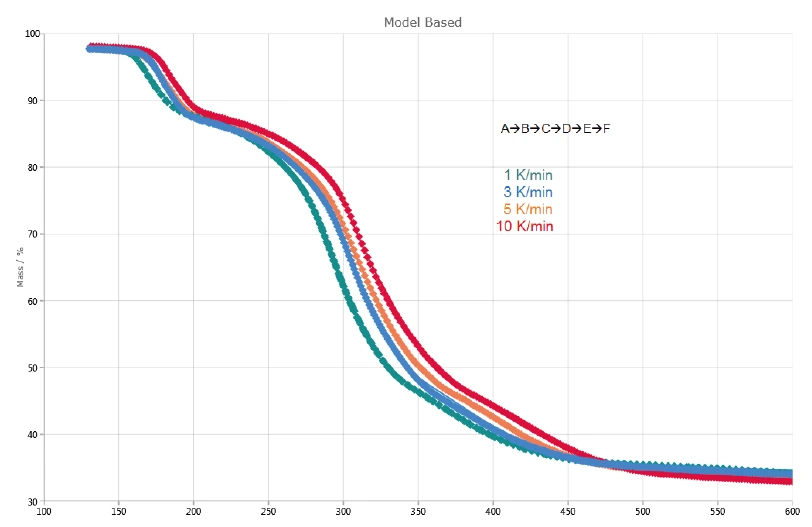
Şekil 2'de potasyum klavulanat üzerinde 1, 3, 5 ve 10 K/dak ısıtma hızlarında yapılan ölçümlerin TGA ve DTG (birinci türev) eğrileri gösterilmektedir. Oda sıcaklığı ile 120°C arasında tespit edilen ilk kütle kaybı adımı, yüzey suyunun buharlaşmasından kaynaklanmaktadır [13]. Ayrıca, 120°C ile 600°C arasında tespit edilen üç kütle kaybı adımı potasyum klavulanatın ayrışmasından kaynaklanmaktadır. Artan ısıtma hızlarıyla (kinetik etki) daha yüksek sıcaklıklara kaymaktadırlar. Örneğin, 1 K/dak ısıtma hızında ilk Ayrışma reaksiyonuBir ayrışma reaksiyonu, katı ve/veya gaz ürünler oluşturan kimyasal bir bileşiğin termal olarak indüklenen bir reaksiyonudur. ayrışma adımı 167°C'de (DTG piki) gerçekleşirken, 10 K/dak ısıtma hızında 184°C'de (DTG piki) gerçekleşir. Son Ayrışma reaksiyonuBir ayrışma reaksiyonu, katı ve/veya gaz ürünler oluşturan kimyasal bir bileşiğin termal olarak indüklenen bir reaksiyonudur. ayrışma adımı artan ısıtma hızıyla daha belirgin hale gelir: 5 K/dak ısıtma hızında 412°C'de (kırmızı kesikli eğri) bir DTG piki gözlenirken, 10 K/dak'da 417°C'de (siyah kesikli eğri) meydana gelir.
Termal Ayrışmanın Kinetik Analizi
Ayrışmanın ısıtma hızına bağımlılığı, NETZSCH Kinetics Neo yazılımı yardımıyla sürecin değerlendirilmesine olanak tanır. Şekil 3, kinetik değerlendirme için kullanılan 130°C ile 600°C arasındaki TGA ölçüm eğrilerini göstermektedir. 130°C'den daha düşük sıcaklıklarda yüzey suyunun salınımı dikkate alınmamıştır.
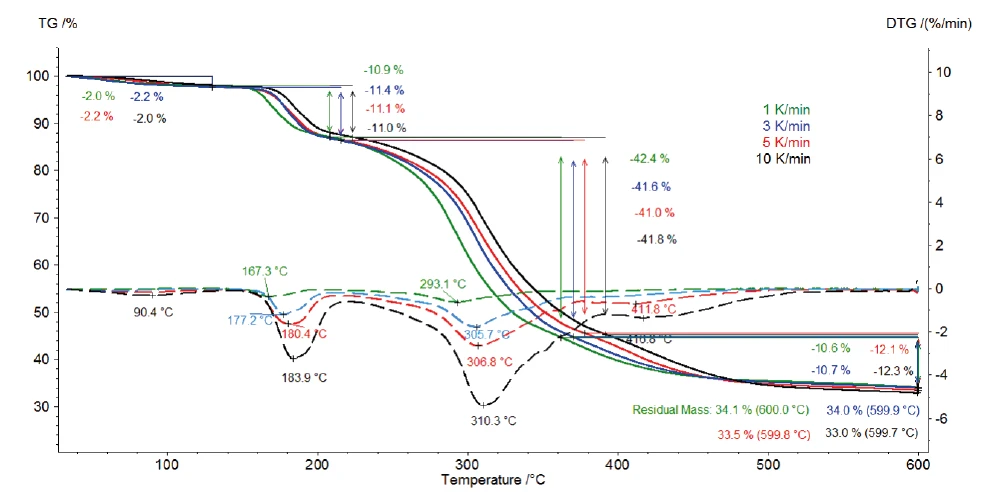
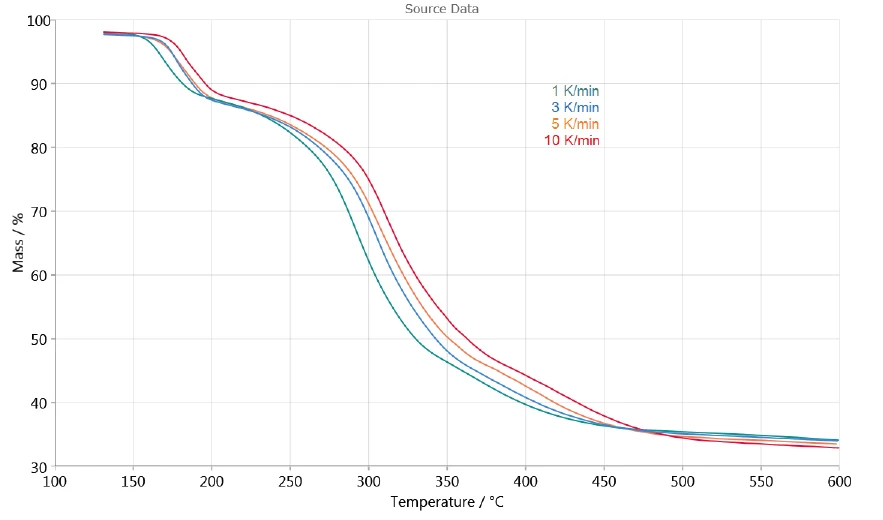
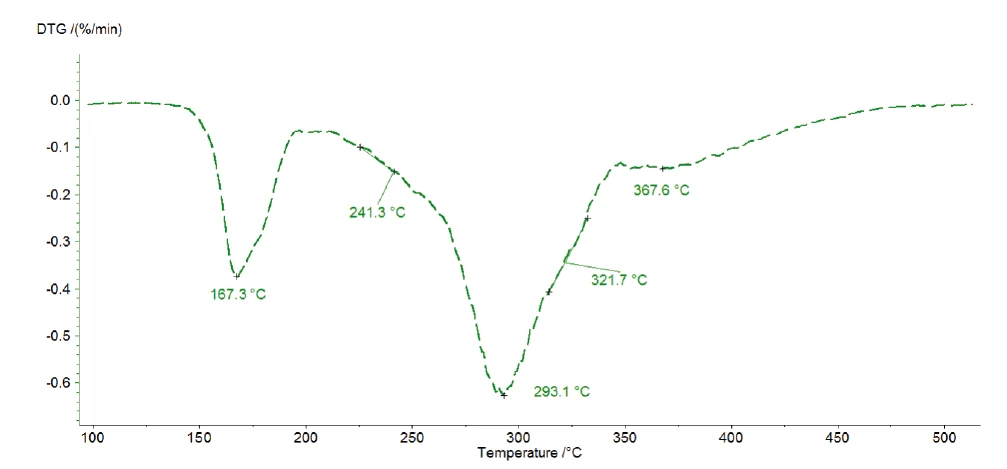
Tespit edilen üç ardışık kütle kaybı en az üç Ayrışma reaksiyonuBir ayrışma reaksiyonu, katı ve/veya gaz ürünler oluşturan kimyasal bir bileşiğin termal olarak indüklenen bir reaksiyonudur. ayrışma adımına işaret etmektedir. Şekil 4'te sunulan 1 K/dak'lık ölçümün DTG eğrisi 167°C, 293°C ve 368°C'de üç tepe noktası ve aynı zamanda 241°C ve 322°C'de başlangıç sıcaklıklarına sahip iki omuz göstermektedir. Kinetics Neo'nun n . dereceden beş ardışık adımlı bir kinetik model önermesinin nedeni budur.
Her j adımının reaksiyon hızı şu fonksiyonla tanımlanır: Reaksiyon Hızı =Aj - f(ej,pj) - exp[-Ej/RT]
Aj: ön-eksponansiyel faktör
Ej: aktivasyon enerjisi [J.mol-1]
T: sıcaklık [K]
R: gaz sabiti (8.314 J.K-1.mol-1)
f(ej,pj):
başlangıç reaktifiej ve ürün pj konsantrasyonuna bağlı fonksiyon
Şekil 5, ölçülen TGA eğrilerini (noktalı çizgiler) seçilen 5 adımlı modelin hesaplanan eğrileriyle (düz çizgiler) karşılaştırmaktadır. Ölçülen ve hesaplanan veriler arasında >0,999 gibi yüksek bir korelasyon katsayısı elde edilmiştir.
Tablo 1, her bir adım için kinetik değerlendirme sonuçlarını özetlemektedir. Teorik kütle kaybı, reaksiyon adımının ayrışmaya katkısı ile Ayrışma reaksiyonuBir ayrışma reaksiyonu, katı ve/veya gaz ürünler oluşturan kimyasal bir bileşiğin termal olarak indüklenen bir reaksiyonudur. ayrışma sırasında meydana gelen toplam kütle kaybının çarpılmasıyla hesaplanır.
İlk Ayrışma reaksiyonuBir ayrışma reaksiyonu, katı ve/veya gaz ürünler oluşturan kimyasal bir bileşiğin termal olarak indüklenen bir reaksiyonudur. ayrışma adımı olan A→B, %11,9'luk bir hesaplanmış kütle kaybıyla ilişkilidir ve %11'lik deneysel değerlere karşılık gelmektedir. Son adım olan E→F için kütle kaybı %13,9'dur. Bu, deneysel değer olan %11-12'den biraz daha yüksektir. Bu da son kütle kaybı adımının daha erken başladığı anlamına gelmektedir (< 360°C). B→C, C→D ve D→E adımlarının toplam kütle kaybı %36,9'dur ve şekil 2'deki 300°C (DTG piki) civarındaki karmaşık Ayrışma reaksiyonuBir ayrışma reaksiyonu, katı ve/veya gaz ürünler oluşturan kimyasal bir bileşiğin termal olarak indüklenen bir reaksiyonudur. ayrışma sürecine karşılık gelmektedir.
Tab 1: Potasyum klavulanatın termal bozunmasının kinetik parametreleri
| Reaksiyon adımı | A → B | B → C | C → D | D → E | E → F |
|---|---|---|---|---|---|
| Aktivasyon enerjisi [kJ/mol] | 265.1 | 240.8 | 260.5 | 179.8 | 166.5 |
| Üstel öncesi faktör | 28.6 | 21.6 | 21.7 | 13.3 | 10.5 |
| Reaksiyon düzeni | 3.6 | 2.1 | 1.8 | 1.6 | 3.4 |
| Katkı | 0.190 | 0.099 | 0.244 | 0.246 | 0.222 |
| Teorik kütle kaybı | 11.9% | 6.2% | 15.3% | 15.4% | 13.9% |
Ölçümlerin n'inci dereceden reaksiyonlarla iyi korelasyonu, [8]'de çözeltilerdeki Ayrışma reaksiyonuBir ayrışma reaksiyonu, katı ve/veya gaz ürünler oluşturan kimyasal bir bileşiğin termal olarak indüklenen bir reaksiyonudur. ayrışma davranışının aksine, potasyum klavulanatın katı halde ayrışmasının otomatik katalizlenmediği sonucunu doğrulamaktadır.
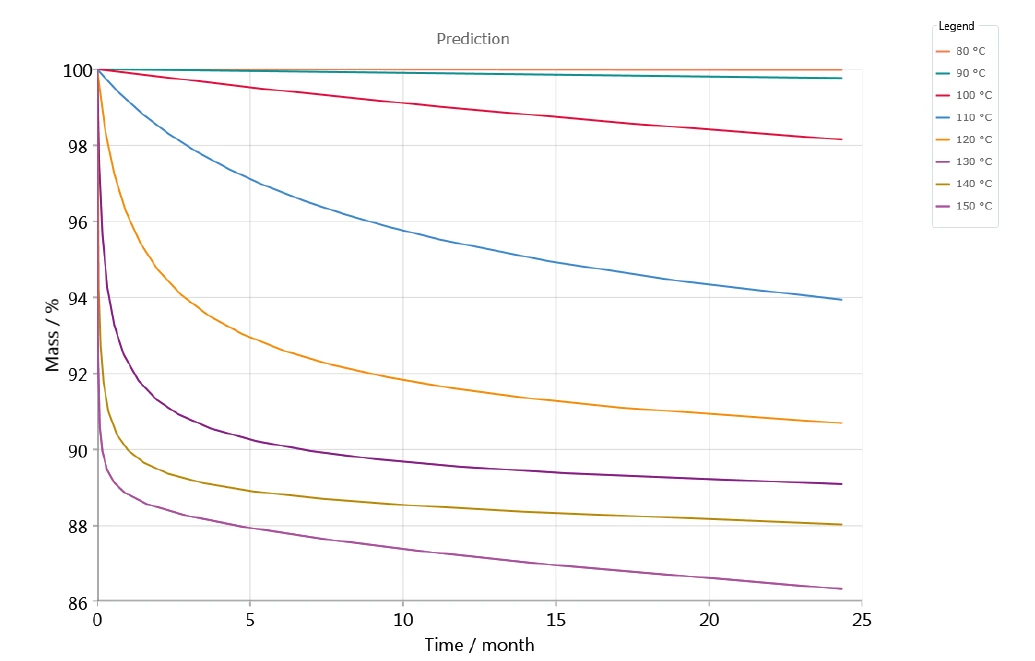
Kinetik değerlendirme, yüksek bir korelasyon katsayısı ve dolayısıyla ölçülen ve simüle edilen TGA eğrileri arasında yüksek düzeyde bir uyum ile gerçekleştirilmiştir, böylece farklı depolama sıcaklıkları altında uzun vadeli davranış hakkında tahminler mümkündür. Örnek olarak, Şekil 6, ardışık adımlara sahip 5 adımlı modele dayanan zamana karşı kütle değişimini göstermektedir; azot atmosferinde 80°C ile 150°C arasındaki çeşitli sıcaklıklar için potasyum klavulanatın ayrışmasının tahminini temsil etmektedir. Artan sıcaklıkla birlikte ayrışma artar. Bu etki 90°C'lik bir depolama sıcaklığında gözlemlenebilir (grafiğin üst ucundaki yeşil eğri - Şekil 6).
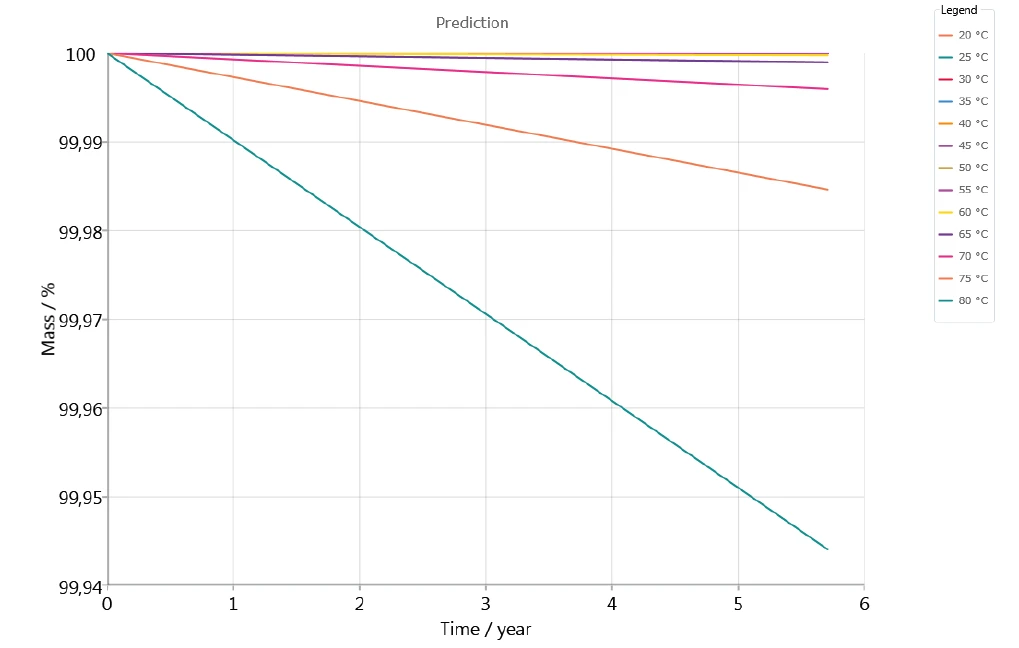
Şekil 7, 20°C ile 80°C arasındaki sıcaklıklar için 5 yıl boyunca ilacın inert atmosferdeki stabilitesini göstermektedir. Görünüşe göre 60°C'ye kadar olan sıcaklıklar için yapılan tahminde önemli bir kütle kaybı meydana gelmemektedir.
Burada ayrışma kinetiğinin kuru bir numune üzerinde gerçekleştirildiğini hatırlatmak gerekir. Bununla birlikte, suyun potasyum klavulanatın ayrışması üzerinde büyük etkisi vardır: Nemli bir atmosferde depolanması ayrışmasını daha düşük sıcaklıklara kaydırır [10]. J. Cieleka-Piontek, potasyum klavulanat numunelerinin kuru havaya maruz kaldıklarından daha yüksek hava nemine maruz kaldıklarında daha hızlı ayrıştığını göstermekte ve bir su molekülünün ß-laktam halkasının karbonil grubuna saldırmasının termolizi tetiklediğini öne sürmektedir [8].
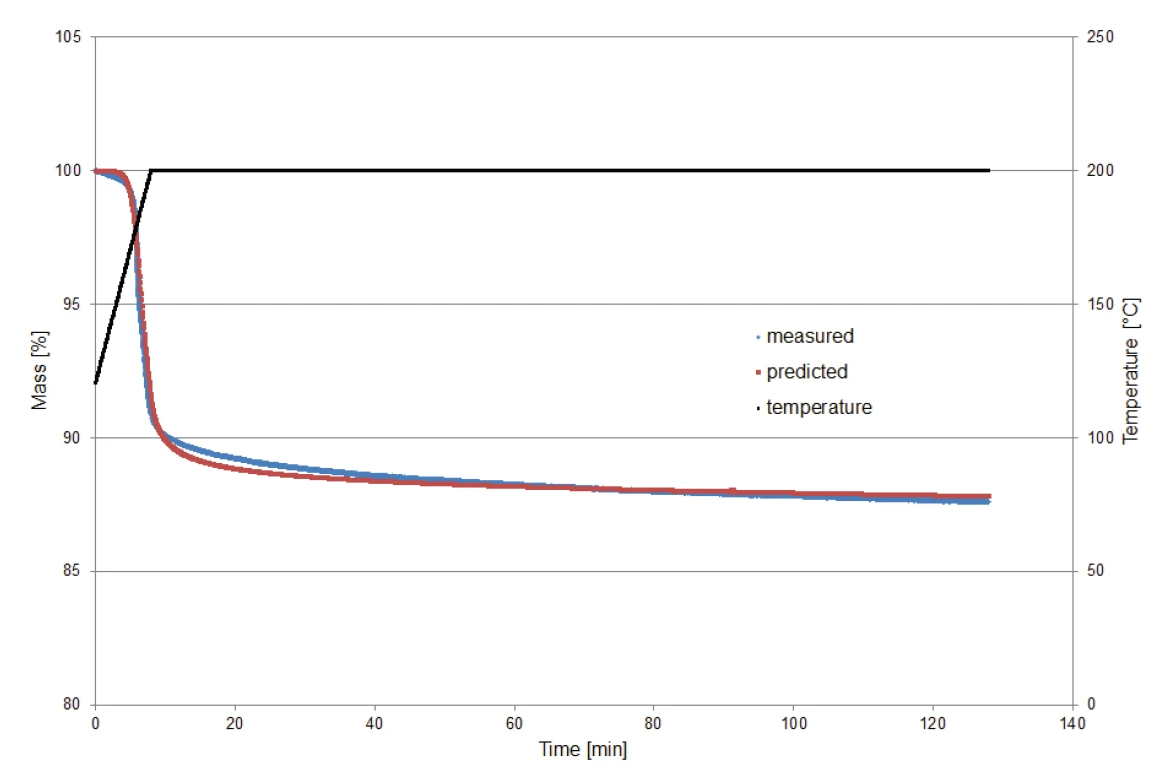
İzotermal koşullar altında bozunma davranışının tahmini için Kinetics Neo tarafından hesaplanan kinetik modeli doğrulamak amacıyla, 9,23 mg'lık bir potasyum klavulanat örneği 200°C'ye ısıtılmış ve ardından iki saat boyunca İzotermalKontrollü ve sabit sıcaklıkta yapılan testlere izotermal denir.izotermal olarak tutulmuştur. Ölçümün izlenmesi, yüzey suyunun salınmasının kütle kaybı etkisini dışlamak için 120°C'de başlamıştır.
Şekil 8, ölçüm yoluyla belirlenen kütle kayıplarını tahmin yoluyla belirlenenlerle karşılaştırmaktadır (Kinetics Neo). Karşılaştırma, iki eğri arasındaki iyi uyumu ve dolayısıyla hesaplamanın güvenilirliğini göstermektedir.
Sonuç
Potasyum klavulanatın azot altında katı halde termal ayrışmasının kinetiği termogravimetri ve Kinetik Neo ile araştırılmıştır. Ölçülen ve simüle edilen veriler arasında yüksek düzeyde bir korelasyon, her bir adımın n. dereceden olduğu ardışık beş adımlı bir kinetik model kullanılarak elde edilebilir. Bu, farklı sıcaklıklar, sıcaklık profilleri ve süreler altında depolama davranışının tahmin edilmesini sağlar.
Sonuçlar, İzotermalKontrollü ve sabit sıcaklıkta yapılan testlere izotermal denir.izotermal segment de dahil olmak üzere belirli bir sıcaklık profili altında TGA ölçümü ile Kinetics Neo tarafından hesaplanan tahminler karşılaştırılarak doğrulanmıştır.