Introduzione
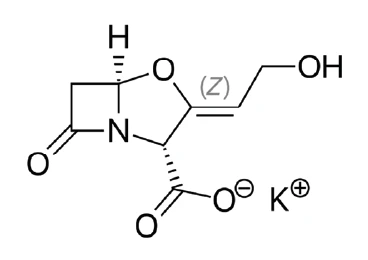
Il clavulanato di potassio (figura 1) è un sale dell'acido clavulanico, un importante antibiotico ß-lattamico prodotto dall'organismo Streptomyces clavuligerus [1]. Da solo è in grado di svolgere solo una debole attività antibatterica contro la maggior parte degli organismi, ma in combinazione con l'antibiotico amoxicillina è efficace contro i batteri stafilococchi produttori di ß-lattamasi resistenti alla sola amoxicillina [2, 3]. Per questo motivo è una sostanza consolidata nell'industria farmaceutica.
L'amoxicillina e il clavulanato di potassio presentano percorsi di Reazione di decomposizioneUna reazione di decomposizione è una reazione termicamente indotta di un composto chimico che forma prodotti solidi e/o gassosi. decomposizione simili. Tuttavia, la stabilità della combinazione amoxicillina-clavulanato dipende principalmente dal clavulanato, che è il più degradabile dei due [4, 5].
La Reazione di decomposizioneUna reazione di decomposizione è una reazione termicamente indotta di un composto chimico che forma prodotti solidi e/o gassosi. decomposizione del clavulanato di potassio è stata studiata in molti lavori [3, 4, 7, 12]. In generale, la sostanza è stata studiata in soluzioni con diversi livelli di pH e in presenza di amoxicillina. È stato osservato che la stabilità della miscela amoxicillina/acido clavulanico è influenzata dall'aumento della temperatura da 25°C a 40°C [3]. D'altra parte, la durata di conservazione della miscela aumenta significativamente se il pH della soluzione viene acidificato [4]. È stato inoltre osservato che nelle soluzioni la Reazione di decomposizioneUna reazione di decomposizione è una reazione termicamente indotta di un composto chimico che forma prodotti solidi e/o gassosi. decomposizione dell'acido clavulanico è catalizzata dai prodotti dell'idrolisi [12]. Come è stato dimostrato utilizzando il metodo HPLC su campioni conservati a diverse temperature e in diverse condizioni atmosferiche, la Reazione di decomposizioneUna reazione di decomposizione è una reazione termicamente indotta di un composto chimico che forma prodotti solidi e/o gassosi. decomposizione del clavulanato di potassio allo stato solido segue un altro meccanismo: I prodotti di Reazione di decomposizioneUna reazione di decomposizione è una reazione termicamente indotta di un composto chimico che forma prodotti solidi e/o gassosi. decomposizione formati nella fase solida non hanno alcun effetto catalitico [8].
La Stabilità termicaUn materiale è termicamente stabile se non si decompone sotto l'influenza della temperatura. Un modo per determinare la stabilità termica di una sostanza è quello di utilizzare un TGA (analizzatore termogravimetrico). stabilità termica può essere esplorata anche con la termogravimetria, che determina, tra l'altro, la temperatura alla quale un materiale inizia a decomporsi o a reagire [9]. La Reazione di decomposizioneUna reazione di decomposizione è una reazione termicamente indotta di un composto chimico che forma prodotti solidi e/o gassosi. decomposizione termica del clavulanato di potassio solido è stata caratterizzata mediante una termobilancia accoppiata a uno spettrometro FT-IR in [13]. Di seguito, le misure termogravimetriche vengono utilizzate per effettuare studi cinetici della Reazione di decomposizioneUna reazione di decomposizione è una reazione termicamente indotta di un composto chimico che forma prodotti solidi e/o gassosi. reazione di decomposizione.
Ciò consente di prevedere la degradazione del clavulanato di potassio per specifiche condizioni di temperatura e tempo. La conoscenza della Stabilità termicaUn materiale è termicamente stabile se non si decompone sotto l'influenza della temperatura. Un modo per determinare la stabilità termica di una sostanza è quello di utilizzare un TGA (analizzatore termogravimetrico). stabilità termica e la comprensione del processo di Reazione di decomposizioneUna reazione di decomposizione è una reazione termicamente indotta di un composto chimico che forma prodotti solidi e/o gassosi. decomposizione del clavulanato di potassio allo stato solido consentono di ottimizzare le condizioni di conservazione.
Sperimentale
Le misure TGA sono state eseguite con una termobilancia NETZSCH TG 209 F1 Libra® con cambio automatico del campione. Dalla misurazione TGA-FT-IR descritta in [13], abbiamo appreso che il campione rilascia acqua in superficie non appena inizia la misurazione. Per questo motivo, le misure successive sono state eseguite utilizzando crogioli di alluminio chiusi. Appena prima della misura, il coperchio del crogiolo è stato forato automaticamente dal dispositivo di perforazione dell'ASC. In questo modo si evita che il campione rilasci la sua acqua superficiale già prima dell'inizio della misurazione, cosa che falsificherebbe il valore della massa iniziale.
Le masse dei campioni erano comprese tra 4,33 e 5,04 mg. I campioni sono stati riscaldati tra la temperatura ambiente e 600°C a quattro velocità di riscaldamento che variavano da 1 K/min a 10 K/min. Le misure sono state effettuate in atmosfera dinamica di azoto (40 ml/min).
Le curve TGA ottenute sono la base per la valutazione cinetica della Reazione di decomposizioneUna reazione di decomposizione è una reazione termicamente indotta di un composto chimico che forma prodotti solidi e/o gassosi. reazione di decomposizione.
A tale scopo, è stato utilizzato il software Kinetics Neo (di NETZSCH-Gerätebau GmbH). Il software consente di modellare la cinetica di reazioni da uno a più stadi.
Questo software è in grado di assegnare ogni singola fase a diversi tipi di reazione con parametri cinetici propri, come l'energia di attivazione, l'ordine di reazione e il fattore pre-esponenziale. Sulla base dei risultati, Kinetics Neo è in grado di simulare la reazione (o le reazioni) per programmi di temperatura specificati dall'utente.
Risultati e discussione
Misure TGA
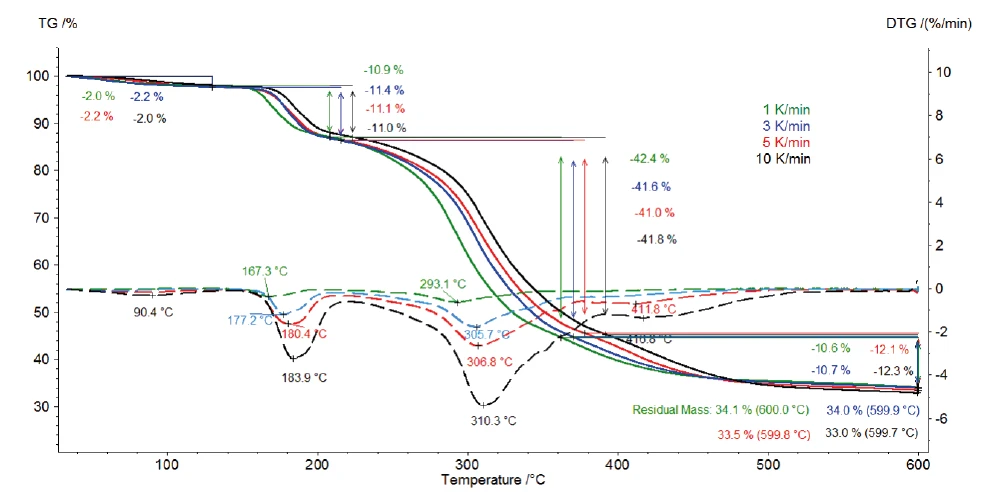
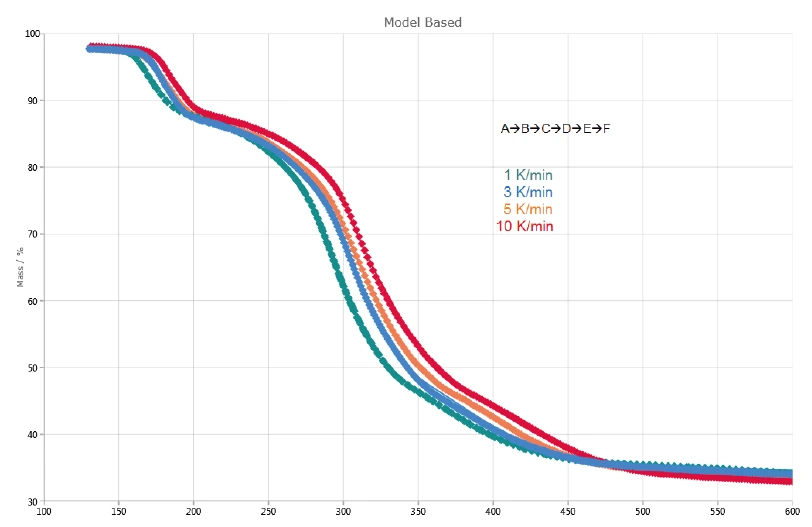
La Figura 2 mostra le curve TGA e DTG (prima derivata) delle misure sul clavulanato di potassio a velocità di riscaldamento di 1, 3, 5 e 10 K/min. La prima fase di perdita di massa, rilevata tra la temperatura ambiente e i 120°C, deriva dall'evaporazione dell'acqua superficiale [13]. Inoltre, le tre fasi di perdita di massa individuate tra 120°C e 600°C sono dovute alla Reazione di decomposizioneUna reazione di decomposizione è una reazione termicamente indotta di un composto chimico che forma prodotti solidi e/o gassosi. decomposizione del clavulanato di potassio. Esse si spostano a temperature più elevate con l'aumento della velocità di riscaldamento (influenza cinetica). Ad esempio, a una velocità di riscaldamento di 1 K/min, la prima fase di Reazione di decomposizioneUna reazione di decomposizione è una reazione termicamente indotta di un composto chimico che forma prodotti solidi e/o gassosi. decomposizione si verifica a 167°C (picco DTG), mentre a una velocità di riscaldamento di 10 K/min, si verifica a 184°C (picco DTG). L'ultima fase di Reazione di decomposizioneUna reazione di decomposizione è una reazione termicamente indotta di un composto chimico che forma prodotti solidi e/o gassosi. decomposizione diventa più pronunciata con l'aumento della velocità di riscaldamento: Alla velocità di riscaldamento di 5 K/min, si osserva un picco DTG a 412°C (curva tratteggiata rossa), mentre a 10 K/min, si verifica a 417°C (curva tratteggiata nera).
Analisi cinetica della decomposizione termica
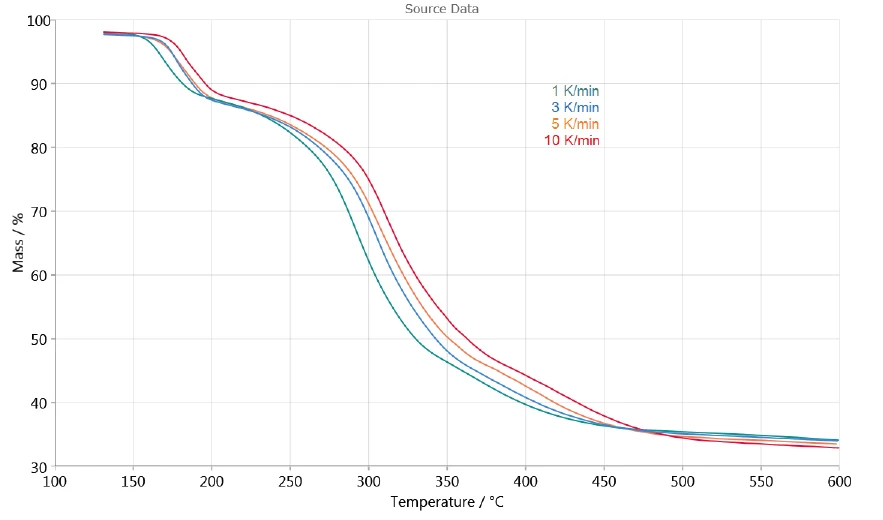
La dipendenza della decomposizione dalla velocità di riscaldamento consente di valutare il processo con l'aiuto del software NETZSCH Kinetics Neo. La Figura 3 mostra le curve di misurazione TGA tra 130°C e 600°C utilizzate per la valutazione cinetica. Il rilascio di acqua superficiale a temperature inferiori a 130°C non è stato preso in considerazione.
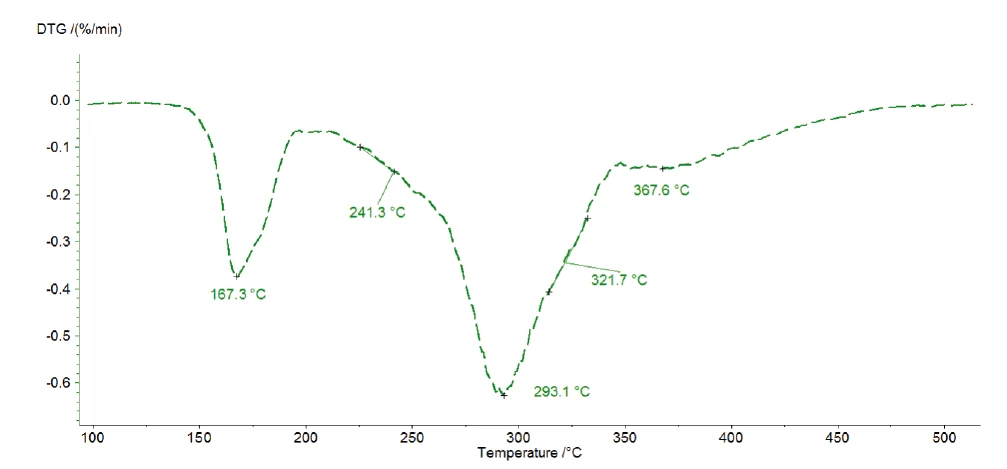
Le tre perdite di massa consecutive rilevate indicano almeno tre fasi di decomposizione. La curva DTG della misurazione a 1 K/min presentata in figura 4 mostra tre picchi a 167°C, 293°C e 368°C, ma anche due spalle con temperature di insorgenza a 241°C e 322°C. Per questo motivo Kinetics Neo propone un modello cinetico con cinque fasi consecutive di ordine n-esimo .
La velocità di reazione di ogni fase j è descritta dalla funzione: Tasso di reazionej =Aj - f(ej,pj) - exp[-Ej/RT]
Aj: fattore pre-esponenziale
Ej: energia di attivazione [J.mol-1]
T: temperatura [K]
R: costante del gas (8,314 J.K-1.mol-1)
f(ej,pj): funzione dipendente dalla concentrazione del
reagente iniziale ej e dalla concentrazione del prodotto pj
La Figura 5 confronta le curve TGA misurate (linee tratteggiate) con le curve calcolate (linee solide) del modello a 5 fasi scelto. Tra i dati misurati e quelli calcolati si ottiene un elevato coefficiente di correlazione, pari a >0,999.
La Tabella 1 riassume i risultati della valutazione cinetica per ogni fase. La perdita di massa teorica è calcolata moltiplicando il contributo della fase di reazione alla decomposizione con la perdita di massa totale che si verifica durante la decomposizione.
La prima fase di decomposizione, A→B, è associata a una perdita di massa calcolata dell'11,9% e corrisponde ai valori sperimentali dell'11%. La perdita di massa per l'ultima fase, E→F, è pari al 13,9%. È leggermente superiore al valore sperimentale dell'11-12%. Ciò significa che l'ultima fase di perdita di massa inizia prima (< 360°C). La perdita di massa totale dei passaggi B→C, C→D e D→E è del 36,9% e corrisponde al complesso processo di decomposizione intorno ai 300°C (picco DTG) in figura 2.
Tab 1: Parametri cinetici della degradazione termica del clavulanato di potassio
| Fase di reazione | A → B | B → C | C → D | D → E | E → F |
|---|---|---|---|---|---|
| Energia di attivazione [kJ/mol] | 265.1 | 240.8 | 260.5 | 179.8 | 166.5 |
| Fattore preesponenziale | 28.6 | 21.6 | 21.7 | 13.3 | 10.5 |
| Ordine di reazione | 3.6 | 2.1 | 1.8 | 1.6 | 3.4 |
| Contributo | 0.190 | 0.099 | 0.244 | 0.246 | 0.222 |
| Perdita di massa teorica | 11.9% | 6.2% | 15.3% | 15.4% | 13.9% |
La buona correlazione delle misure con le reazioni del nono ordine conferma le conclusioni tratte in [8], secondo cui, contrariamente al suo comportamento di decomposizione in soluzione, la decomposizione del clavulanato di potassio allo stato solido non è autocatalizzata.
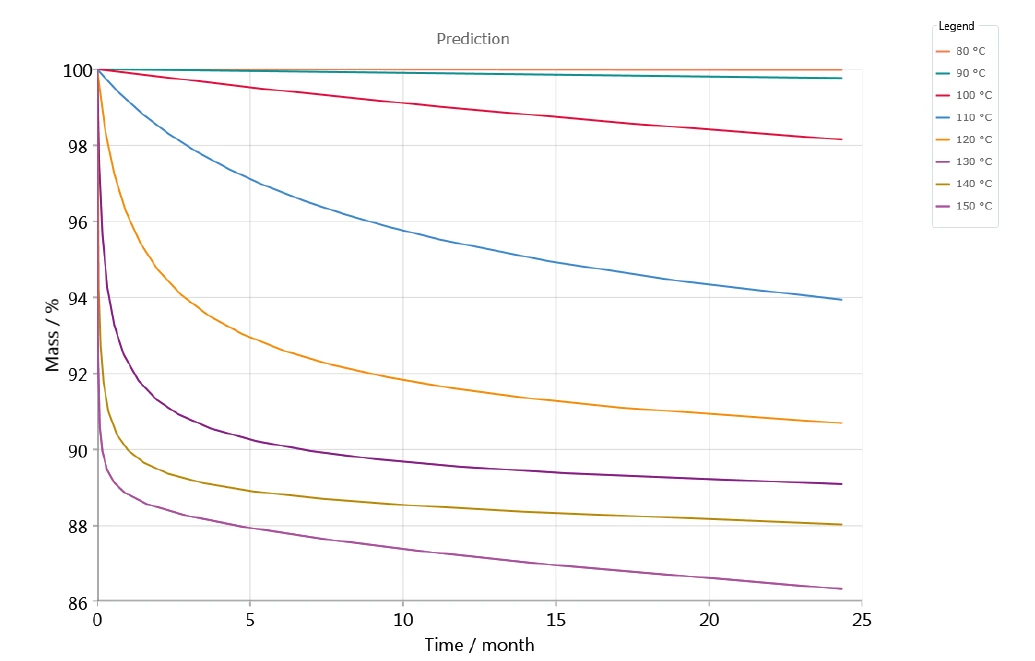
La valutazione cinetica è stata effettuata con un elevato coefficiente di correlazione e quindi un alto livello di accordo tra le curve TGA misurate e simulate, in modo da rendere possibili previsioni sul comportamento a lungo termine a diverse temperature di stoccaggio. A titolo di esempio, la figura 6 mostra la variazione di massa rispetto al tempo in base al modello a 5 fasi consecutive; rappresenta la previsione della decomposizione del clavulanato di potassio per varie temperature comprese tra 80°C e 150°C in atmosfera di azoto. Con l'aumento della temperatura, la decomposizione aumenta. Questo effetto può essere osservato già a una temperatura di stoccaggio di 90°C (curva verde all'estremità superiore del grafico - figura 6).
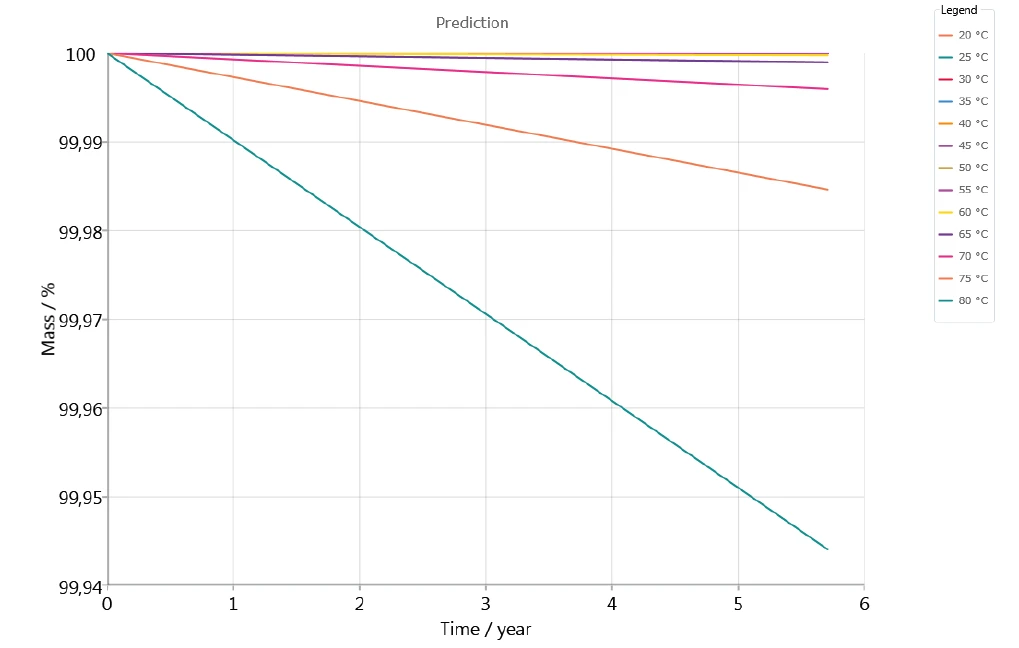
La figura 7 illustra la stabilità in atmosfera inerte del farmaco nel corso di 5 anni, per temperature comprese tra 20°C e 80°C. Sembra che non si verifichi alcuna perdita di massa significativa nella previsione per temperature fino a 60°C.
È opportuno ricordare che la cinetica di decomposizione è stata effettuata su un campione secco. Tuttavia, l'acqua ha una grande influenza sulla decomposizione del clavulanato di potassio: Lo stoccaggio in atmosfera umida sposta la decomposizione a temperature più basse [10]. J. Cieleka-Piontek mostra che i campioni di clavulanato di potassio si decompongono più velocemente se esposti a un aumento dell'umidità dell'aria rispetto all'aria secca e suggerisce che l'attacco di una molecola d'acqua al gruppo carbonilico dell'anello ß-lattamico induce la termolisi [8].
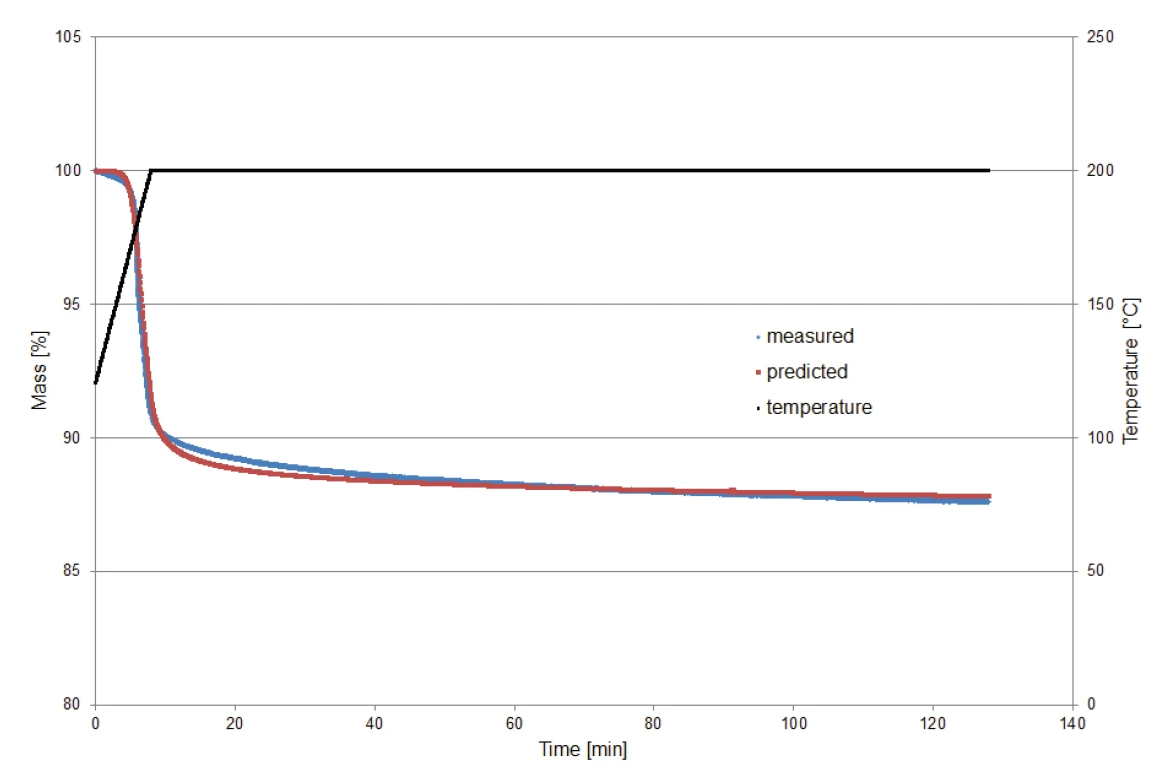
Per convalidare il modello cinetico calcolato da Kinetics Neo per la previsione del comportamento di decomposizione in condizioni isoterme, un campione di clavulanato di potassio di 9,23 mg è stato riscaldato a 200°C e poi mantenuto isotermo per due ore. Il monitoraggio della misura è iniziato a 120°C per escludere l'effetto di perdita di massa dovuto al rilascio di acqua superficiale.
La Figura 8 confronta le perdite di massa determinate tramite misurazione con quelle determinate tramite previsione (Kinetics Neo). Il confronto mostra il buon accordo tra le due curve e quindi l'affidabilità del calcolo.
Conclusione
La cinetica della decomposizione termica del clavulanato di potassio allo stato solido sotto azoto è stata studiata mediante termogravimetria e cinetica Neo. Un elevato livello di correlazione tra i dati misurati e quelli simulati può essere ottenuto utilizzando un modello cinetico a cinque fasi consecutive, dove ogni fase è di ordine n-esimo. Ciò consente di prevedere il comportamento di stoccaggio a diverse temperature, profili di temperatura e periodi.
I risultati sono stati convalidati confrontando le misure TGA sotto un profilo di temperatura specifico, compreso il segmento IsotermicoI test a temperatura controllata e costante sono detti isotermici.isotermico, con le previsioni calcolate da Kinetics Neo.