Wprowadzenie
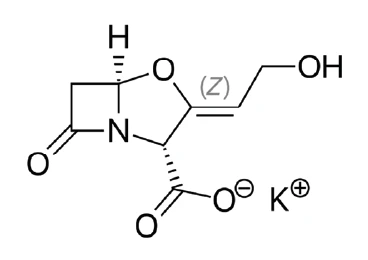
Klawulanian potasu (rysunek 1) jest solą kwasu klawulanowego, który jest głównym antybiotykiem ß-laktamowym wytwarzanym przez organizm Streptomyces clavuligerus [1]. Samodzielnie wykazuje jedynie słabą aktywność przeciwbakteryjną przeciwko większości organizmów, ale w połączeniu z antybiotykiem amoksycyliną jest skuteczny przeciwko bakteriom gronkowcowym wytwarzającym ß-laktamy, które są oporne na samą amoksycylinę [2, 3]. Dlatego jest to substancja o ugruntowanej pozycji w przemyśle farmaceutycznym.
Amoksycylina i klawulanian potasu wykazują podobne ścieżki rozkładu. Jednak stabilność kombinacji amoksycyliny i klawulanianu zależy głównie od klawulanianu, który jest bardziej degradowalny z tych dwóch [4, 5].
Rozkład klawulanianu potasu był badany w wielu pracach [3, 4, 7, 12]. Ogólnie rzecz biorąc, substancję badano w roztworach o różnych poziomach pH i w obecności amoksycyliny. Zaobserwowano, że na stabilność domieszki amoksycylina/kwas klawulanowy wpływa wzrost temperatury z 25°C do 40°C [3]. Z drugiej strony, okres trwałości domieszki znacznie wzrasta, jeśli pH roztworu jest zakwaszone [4]. Zaobserwowano również, że w roztworachReakcja rozkładuReakcja rozkładu to wywołana termicznie reakcja związku chemicznego tworząca produkty stałe i/lub gazowe. rozkład kwasu klawulanowego jest katalizowany przez produkty hydrolizy [12]. Jak wykazano przy użyciu metody HPLC na próbkach przechowywanych w różnych temperaturach i w różnych warunkach atmosferycznych, rozkład klawulanianu potasu w stanie stałym przebiega według innego mechanizmu: Produkty rozkładu powstające w fazie stałej nie mają żadnego efektu katalitycznego [8].
Stabilność termiczną można również zbadać za pomocą termograwimetrii, która określa między innymi temperaturę, w której materiał zaczyna się rozkładać lub reagować [9]. Rozkład termiczny stałego klawulanianu potasu został scharakteryzowany za pomocą termobalansu sprzężonego ze spektrometrem FT-IR w [13]. W dalszej części, pomiary termograwimetryczne są wykorzystywane do przeprowadzania badań kinetycznych reakcji rozkładu.
Pozwala to na przewidywanie degradacji klawulanianu potasu w określonych warunkach temperatury i czasu. Znajomość stabilności termicznej i zrozumienie procesu rozkładu klawulanianu potasu w stanie stałym pozwala na optymalizację warunków jego przechowywania.
Eksperymentalny
Pomiary TGA przeprowadzono za pomocą wagi termometrycznej NETZSCH TG 209 F1 Libra® z automatycznym podajnikiem próbek. Z pomiarów TGA-FT-IR opisanych w [13] dowiedzieliśmy się, że próbka uwalnia wodę powierzchniową natychmiast po rozpoczęciu pomiaru. Z tego powodu kolejne pomiary zostały przeprowadzone przy użyciu zamkniętych tygli aluminiowych. Tuż przed pomiarem pokrywa tygla została automatycznie przebita przez urządzenie przebijające ASC. Zapobiega to uwolnieniu wody powierzchniowej z próbki jeszcze przed rozpoczęciem właściwego pomiaru, co mogłoby zafałszować wartość masy początkowej.
Masy próbek wynosiły od 4,33 do 5,04 mg. Próbki były ogrzewane w zakresie od temperatury pokojowej do 600°C przy czterech szybkościach ogrzewania wahających się od 1 K/min do 10 K/min. Pomiary przeprowadzono w dynamicznej atmosferze azotu (40 ml/min).
Uzyskane krzywe TGA są podstawą do oceny kinetycznej reakcji rozkładu.
W tym celu wykorzystano oprogramowanie Kinetics Neo ( NETZSCH-Gerätebau GmbH). Umożliwia ono modelowanie kinetyki reakcji jedno- i wieloetapowych.
Oprogramowanie to może przypisać każdy indywidualny etap do różnych typów reakcji z własnymi parametrami kinetycznymi, takimi jak energia aktywacji, kolejność reakcji i współczynnik przedwykładniczy. Na podstawie wyników, Kinetics Neo jest w stanie symulować reakcję (reakcje) dla programów temperaturowych określonych przez użytkownika.
Wyniki i dyskusja
Pomiary TGA
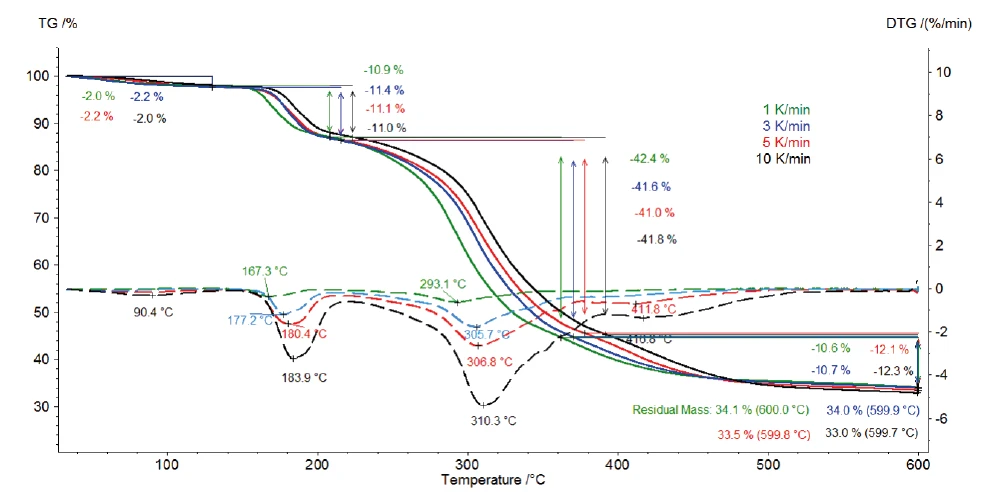
Rysunek 2 przedstawia krzywe TGA i DTG (pierwsza pochodna) pomiarów klawulanianu potasu przy szybkościach ogrzewania 1, 3, 5 i 10 K/min. Pierwszy etap utraty masy, wykryty między temperaturą pokojową a 120°C, wynika z odparowania wody powierzchniowej [13]. Ponadto trzy etapy utraty masy zidentyfikowane między 120°C a 600°C są spowodowane rozkładem klawulanianu potasu. Są one przesuwane do wyższych temperatur wraz ze wzrostem szybkości ogrzewania (wpływ kinetyczny). Na przykład, przy szybkości ogrzewania 1 K/min, pierwszy etap rozkładu zachodzi w temperaturze 167°C (pik DTG), podczas gdy przy szybkości ogrzewania 10 K/min, zachodzi on w temperaturze 184°C (pik DTG). Ostatni etap rozkładu staje się bardziej wyraźny wraz ze wzrostem szybkości ogrzewania: Przy szybkości ogrzewania 5 K/min, pik DTG obserwowany jest przy 412°C (czerwona przerywana krzywa), podczas gdy przy 10 K/min, występuje on przy 417°C (czarna przerywana krzywa).
Analiza kinetyczna rozkładu termicznego
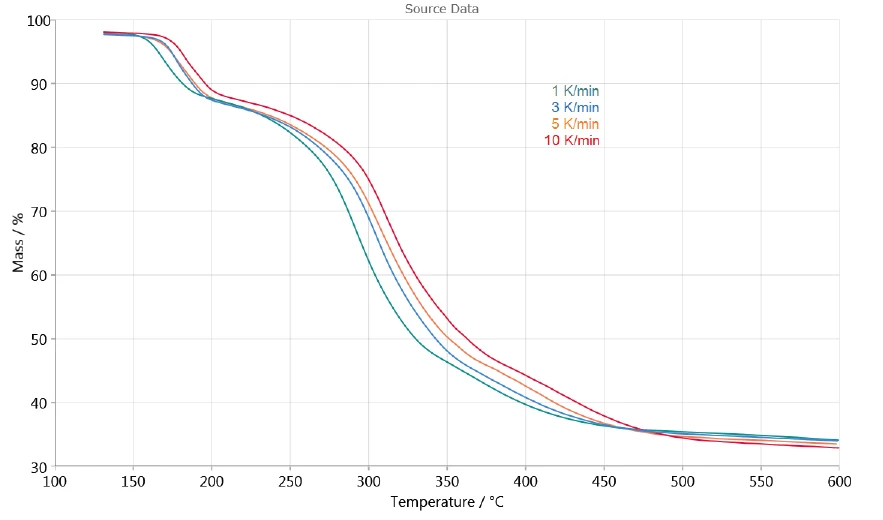
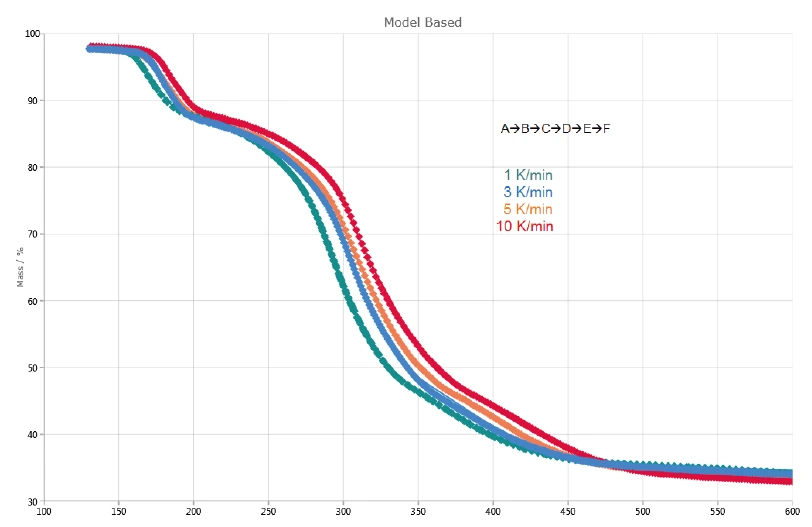
Zależność rozkładu od szybkości ogrzewania pozwala na ocenę procesu za pomocą oprogramowania NETZSCH Kinetics Neo. Rysunek 3 przedstawia krzywe pomiarowe TGA w zakresie od 130°C do 600°C wykorzystane do oceny kinetycznej. Uwalnianie wody powierzchniowej w temperaturach niższych niż 130°C nie jest brane pod uwagę.
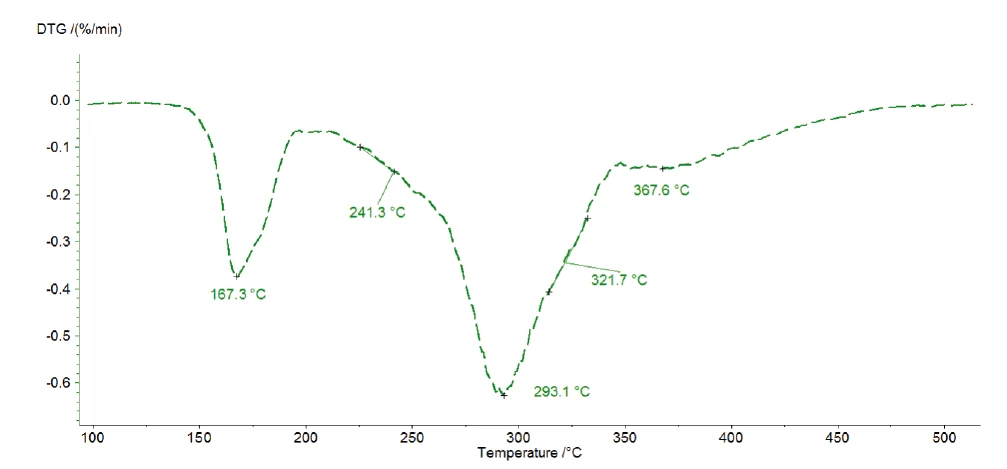
Trzy kolejne wykryte ubytki masy wskazują na co najmniej trzy etapy rozkładu. Krzywa DTG pomiaru przy 1 K/min przedstawiona na rysunku 4 pokazuje trzy piki przy 167°C, 293°C i 368°C, ale także dwa ramiona z temperaturami początkowymi przy 241°C i 322°C. Z tego powodu Kinetics Neo proponuje model kinetyczny z pięcioma kolejnymi etapami n-tego rzędu.
Szybkość reakcji każdego etapu j jest opisana przez funkcję: Reaction Ratej = Aj - f(ej,pj) - exp[-Ej/RT]
Aj: współczynnik przedwykładniczy
Ej: energia aktywacji [J.mol-1]
T: temperatura [K]
R: stała gazowa (8.314 J.K-1.mol-1)
f(ej,pj): funkcja zależna od stężenia
początkowego reagenta ej i stężenia produktu pj
Rysunek 5 porównuje zmierzone krzywe TGA (linie przerywane) z obliczonymi krzywymi (linie ciągłe) wybranego modelu 5-etapowego. Osiągnięto wysoki współczynnik korelacji między danymi zmierzonymi i obliczonymi, wynoszący >0,999.
Tabela 1 podsumowuje wyniki oceny kinetycznej dla każdego etapu. Teoretyczna utrata masy jest obliczana przez pomnożenie udziału etapu reakcji w rozkładzie przez całkowitą utratę masy występującą podczas rozkładu.
Pierwszy etap rozkładu, A→B, wiąże się z obliczoną utratą masy wynoszącą 11,9% i odpowiada wartościom eksperymentalnym wynoszącym 11%. Utrata masy dla ostatniego etapu, E→F, wynosi 13,9%. Jest ona nieco wyższa niż wartość eksperymentalna wynosząca 11-12%. Oznacza to, że ostatni etap utraty masy rozpoczyna się wcześniej (< 360°C). Całkowita utrata masy etapów B→C, C→D i D→E wynosi 36,9% i odpowiada złożonemu procesowi rozkładu około 300°C (pik DTG) na rysunku 2.
Tab. 1: Parametry kinetyczne degradacji termicznej klawulanianu potasu
| Etap reakcji | A → B | B → C | C → D | D → E | E → F |
|---|---|---|---|---|---|
| Energia aktywacji [kJ/mol] | 265.1 | 240.8 | 260.5 | 179.8 | 166.5 |
| Współczynnik przedwykładniczy | 28.6 | 21.6 | 21.7 | 13.3 | 10.5 |
| Kolejność reakcji | 3.6 | 2.1 | 1.8 | 1.6 | 3.4 |
| Wkład | 0.190 | 0.099 | 0.244 | 0.246 | 0.222 |
| Teoretyczna utrata masy | 11.9% | 6.2% | 15.3% | 15.4% | 13.9% |
Dobra korelacja pomiarów z reakcjami n-tego rzędu potwierdza wnioski wyciągnięte w [8], że w przeciwieństwie do rozkładu w roztworach, rozkład klawulanianu potasu w stanie stałym nie jest autokatalizowany.
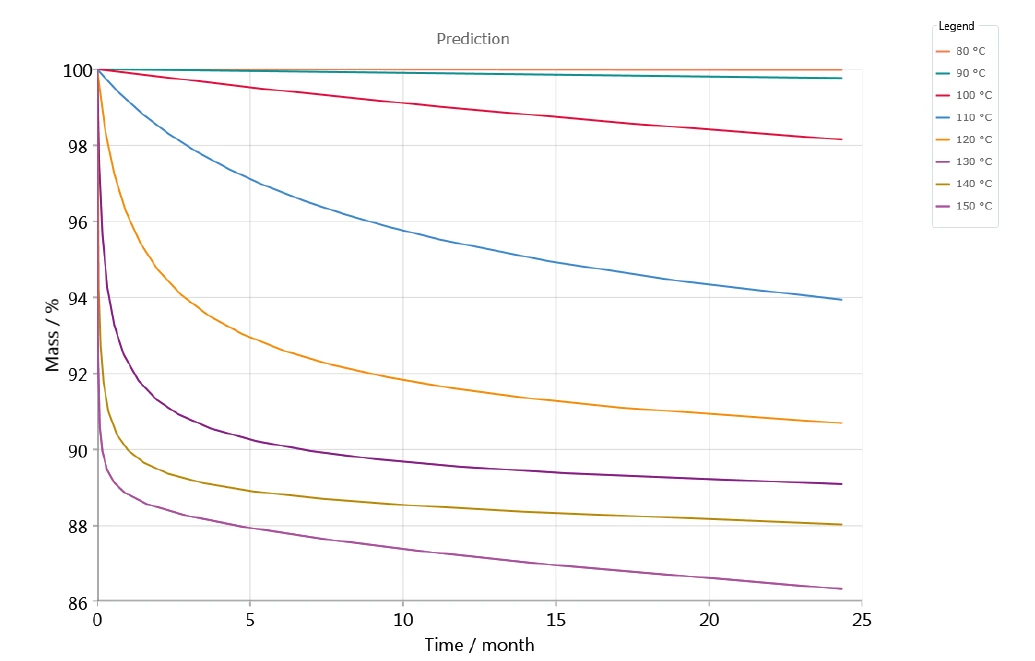
Ocena kinetyczna została przeprowadzona z wysokim współczynnikiem korelacji, a tym samym wysokim poziomem zgodności między zmierzonymi i symulowanymi krzywymi TGA, dzięki czemu możliwe są przewidywania dotyczące długoterminowego zachowania w różnych temperaturach przechowywania. Przykładowo, rysunek 6 przedstawia zmianę masy w funkcji czasu w oparciu o 5-stopniowy model z kolejnymi etapami; przedstawia on przewidywania rozkładu klawulanianu potasu dla różnych temperatur w zakresie od 80°C do 150°C w atmosferze azotu. Wraz ze wzrostem temperaturyReakcja rozkładuReakcja rozkładu to wywołana termicznie reakcja związku chemicznego tworząca produkty stałe i/lub gazowe. rozkład wzrasta. Efekt ten można zaobserwować już w temperaturze przechowywania 90°C (zielona krzywa w górnej części wykresu - rysunek 6).
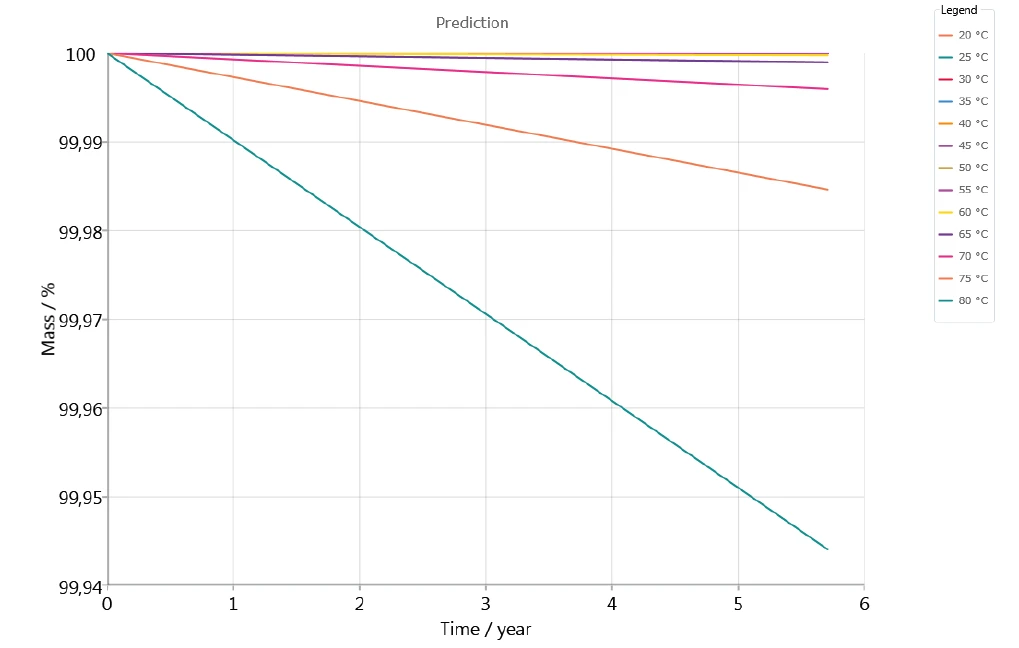
Rysunek 7 przedstawia stabilność leku w atmosferze obojętnej w ciągu 5 lat, dla temperatur od 20°C do 80°C. Wydaje się, że w przewidywaniach dla temperatur do 60°C nie występuje znacząca utrata masy.
W tym miejscu należy przypomnieć, że kinetyka rozkładu została przeprowadzona na suchej próbce. Woda ma jednak duży wpływ naReakcja rozkładuReakcja rozkładu to wywołana termicznie reakcja związku chemicznego tworząca produkty stałe i/lub gazowe. rozkład klawulanianu potasu: Przechowywanie w wilgotnej atmosferze przesuwa jegoReakcja rozkładuReakcja rozkładu to wywołana termicznie reakcja związku chemicznego tworząca produkty stałe i/lub gazowe. rozkład do niższych temperatur [10]. J. Cieleka-Piontek wykazała, że próbki klawulanianu potasu rozkładają się szybciej, jeśli są wystawione na działanie zwiększonej wilgotności powietrza, niż gdy są wystawione na działanie suchego powietrza i sugeruje, że atak cząsteczki wody na grupę karbonylową pierścienia ß-laktamowego indukuje termolizę [8].
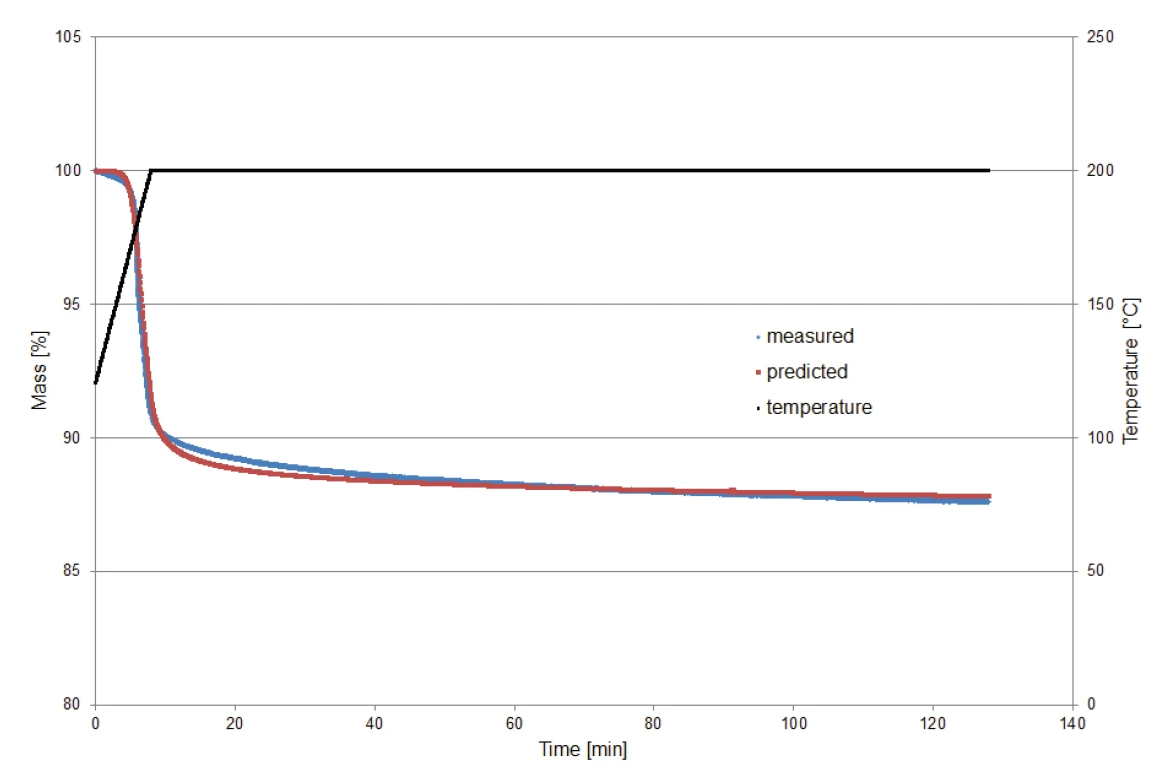
W celu walidacji modelu kinetycznego obliczonego przez Kinetics Neo dla przewidywania zachowania rozkładu w warunkach izotermicznych, próbka klawulanianu potasu o masie 9,23 mg została podgrzana do 200°C, a następnie utrzymywana w warunkach izotermicznych przez dwie godziny. Monitorowanie pomiaru rozpoczęto w temperaturze 120°C w celu wykluczenia efektu ubytku masy spowodowanego uwalnianiem wody powierzchniowej.
Rysunek 8 porównuje ubytki masy ustalone na podstawie pomiarów z tymi ustalonymi na podstawie przewidywań (Kinetics Neo). Porównanie pokazuje dobrą zgodność między dwiema krzywymi, a tym samym wiarygodność obliczeń.
Wnioski
Kinetyka rozkładu termicznego klawulanianu potasu w stanie stałym pod wpływem azotu została zbadana za pomocą termograwimetrii i Kinetics Neo. Wysoki poziom korelacji pomiędzy zmierzonymi i symulowanymi danymi można uzyskać stosując pięcioetapowy model kinetyczny, w którym każdy etap jest n-tego rzędu. Pozwala to na przewidywanie zachowania podczas przechowywania w różnych temperaturach, profilach temperatur i okresach.
Wyniki są weryfikowane poprzez porównanie pomiarów TGA w określonym profilu temperaturowym, w tym w segmencie izotermicznym, z przewidywaniami obliczonymi przez Kinetics Neo.