مقدمة
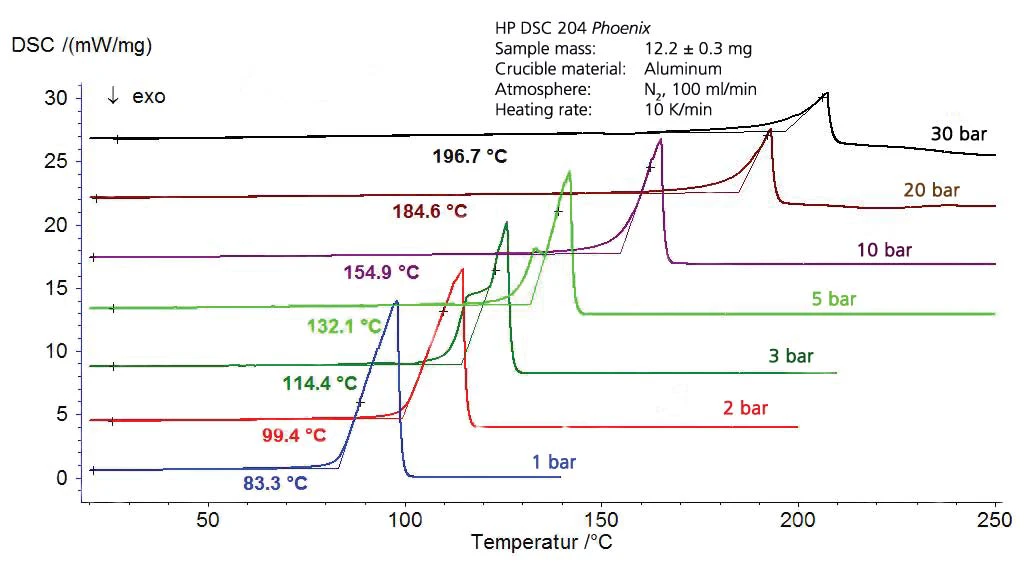
لا يسمح قياس المسح الضوئي التفاضلي بالحرارة (DSC) بتحديد درجات حرارة التحول الطوري فحسب، بل يسمح أيضًا بتحديد درجات حرارة التحول الكمي. يتم تحليل العينات بشكل عام في بوتقات من الألومنيوم بغطاء مثقوب تحت ضغط جوي في تدفق غاز تطهير مستمر. مع الأجهزة المعدلة - حيث يتم تركيب خلية القياس في الأوتوكلاف (ما يسمى DSC بالضغط) - يمكن أيضًا إجراء قياسات في نطاق ضغط يتراوح بين 5 كيلو باسكال و15 ميجا باسكال [1]. في هذه المذكرة التطبيقية، يتم تحليل السوائل فيما يتعلق بسلوك التبخر في نطاق الضغط هذا.
ونظرًا لأن تبخر السوائل قبل الوصول إلى درجة حرارة الغليان والتوازن بين السائل والغاز أثناء الغليان من المعلمات الحرجة التي يمكن أن يكون لها تأثير سلبي على التفاعل والتقييم اللاحق، فقد تم استخدام بوتقات خاصة لهذه القياسات. تم إجراء تجربة جيدة مع هذه البوتقات المصنوعة من الألومنيوم الملحومة على البارد مع ثقب صغير محدد بقطر 50 ميكرومتر.
تصف معادلة أنطوان العلاقة بين ضغط بخار التشبع لمادة نقية ودرجة الحرارة:
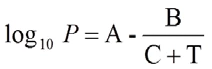
حيث P هو الضغط بوحدة بار، وT هي درجة الحرارة بوحدة كلفن والمتغيرات A وB وC هي ثوابت خاصة بالمكونات. ومع ذلك، لا يمكن استخدام هذه الثوابت لوصف العملية الكاملة لمنحنى نقطة الغليان لمادة ما. لذلك، هناك عدة مجموعات بارامترات للنطاق من النقطة الثلاثية إلى النقطة الحرجة.
يلخص الجدول التالي السوائل التي تم فحصها الماء وسيكلوهكسان الحلقي وخلات الإيثيل والأيزوبروبانول لنطاق صلاحية البيانات الأدبية المستخدمة:
الجدول 1: نطاق درجة الحرارة ومعاملات معادلة أنطوان [3، 4، 5]
| المادة | نطاق درجة الحرارة [كلفن] | نطاق درجة الحرارة [درجة مئوية] | A | B | C |
|---|---|---|---|---|---|
| H2O | 313 ... 385 | 40 ... 112 | 6.1680 | 1397.2 | -48.097 |
| سداسي هـ 12 | 323 ... 523 | 50 ... 250 | 4.1398 | 1316.5 | -35.581 |
| C4H8O2 | 288 ... 348 | 15 ... 75 | 4.2280 | 1245.7 | -55.189 |
| C3H8O | 395 ... 508 | 122 ... 235 | 4.5779 | 1221.4 | -87.474 |
النتائج
الماء
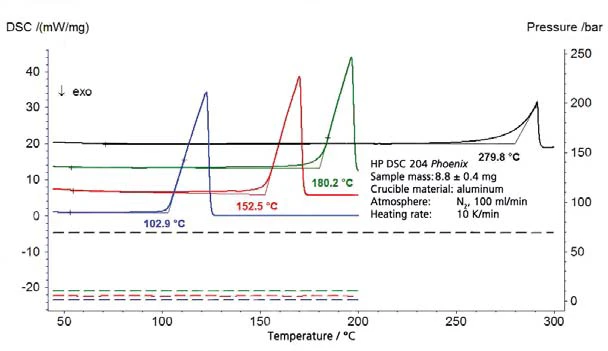
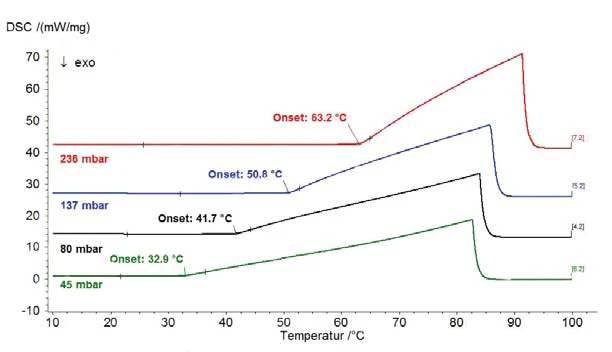
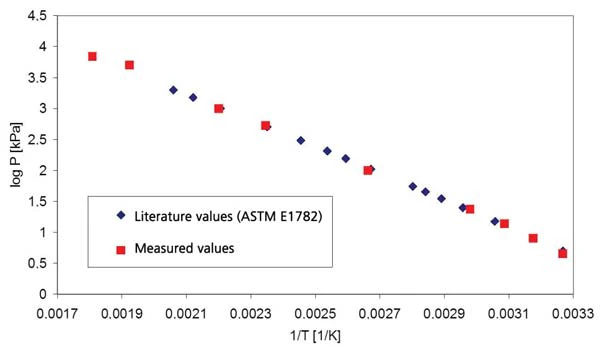
يوضح الشكل 1 النتائج على الماء منزوع البودرة لنطاق الضغط فوق الضغط الجوي (الضغط موضح بخطوط متقطعة)؛ ويوضح الشكل 2 نطاق الضغط بين 45 ملي بار و236 ملي بار. يوضح الشكل 3 الاتفاق الجيد لبيانات الأدبيات من [2] (ASTM E782) مع جميع قيم القياس المحددة.
هكسان حلقي الهكسان
تشمل نتائج هكسان الحلقي الهكسان في نطاق درجات الحرارة بين -20 درجة مئوية و300 درجة مئوية (الشكل 4) كلاً من الغليان والذوبان. ينتج عن هذا الجزء من مخطط الطور المعروض في الشكل 5. يوضح الشكل 6 المقارنة مع الأدبيات [3].
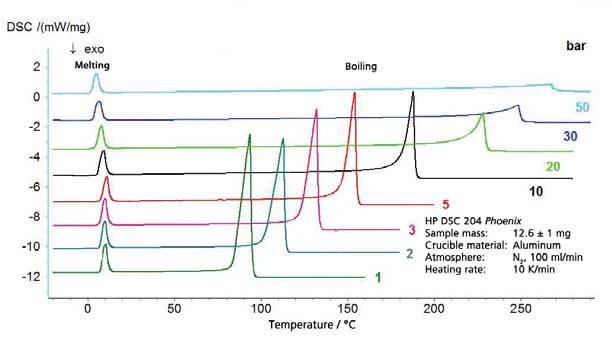
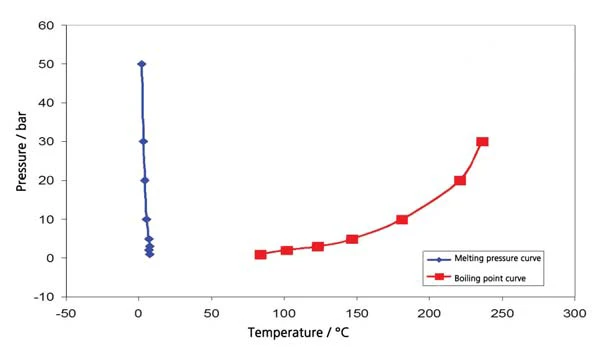
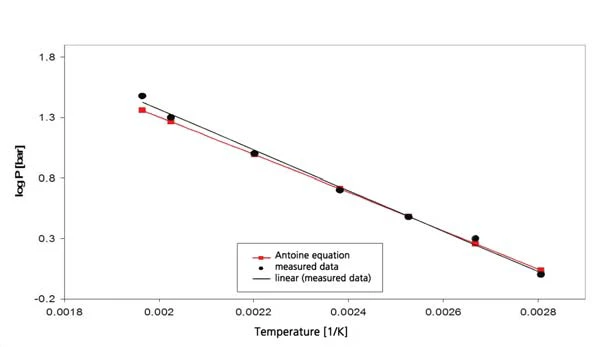
أسيتات الإيثيل
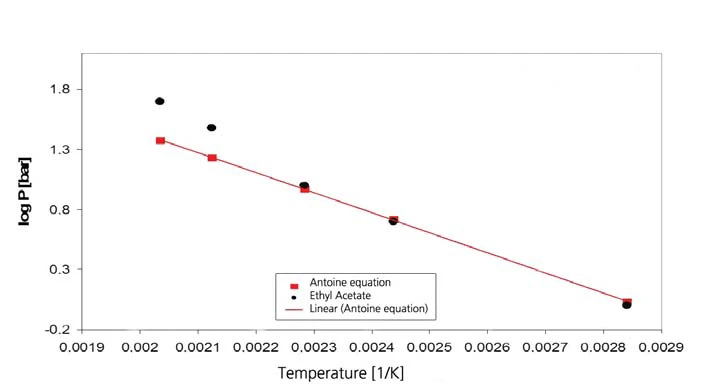
تظهر نتائج أسيتات الإيثيل في الشكلين 7 و8. ومع ذلك، فإن القيم الأدبية هي قيم استقرائية لأن نطاق صلاحية معادلة أنطوان من [4] يقتصر على الفترة بين 15 درجة مئوية و75 درجة مئوية (288 كلفن إلى 348 كلفن (288 كلفن)، وهو ما يقابل قيم مقلوب درجة الحرارة من 0.00347 إلى 0.00287).
الأيزوبروبانول
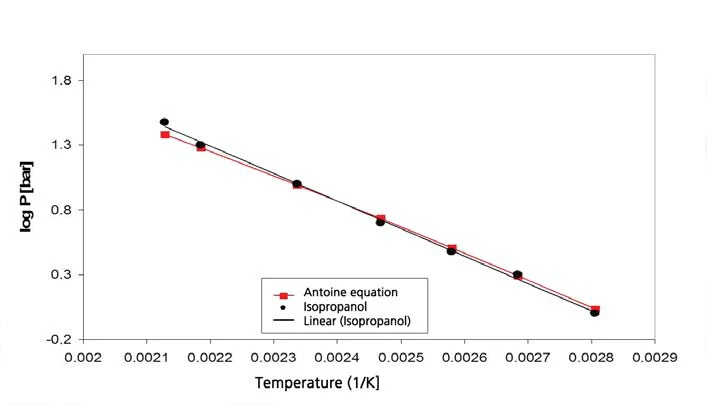
يوضح الشكلان 9 و10 نتائج القياس ومقارنة القيم الأدبية [5] للأيزوبروبانول.
الملخص
يسمح قياس المسح الضوئي التفاضلي الحراري التفاضلي (DSC) - إلى جانب إمكانية تغيرات الضغط داخل خلية القياس - بالتحقيق في اعتماد تحولات الطور على الضغط. تتفق نتائج الانتقال السائل الغازي للمواد التي تم فحصها والماء وسيكلوهكسان وأسيتات الإيثيل والأيزوبروبانول بشكل جيد للغاية مع الأدبيات.