Introdução
A seguir, serão explicados alguns termos específicos do campo farmacêutico:
- Estabilidade térmicaUm material é termicamente estável se não se decompõe sob a influência da temperatura. Uma maneira de determinar a estabilidade térmica de uma substância é usar um TGA (analisador termogravimétrico). Estabilidade térmica
- Compatibilidade
- PolimorfismoPolimorfismo é a capacidade de um material sólido de formar diferentes estruturas cristalinas (sinônimos: formas, modificações).Polimorfismo
- Pseudo-PolimorfismoPolimorfismo é a capacidade de um material sólido de formar diferentes estruturas cristalinas (sinônimos: formas, modificações).polimorfismo
1. Estabilidade térmica
A norma ASTM E2550 descreve a Estabilidade térmicaUm material é termicamente estável se não se decompõe sob a influência da temperatura. Uma maneira de determinar a estabilidade térmica de uma substância é usar um TGA (analisador termogravimétrico). estabilidade térmica de um material como a "temperatura na qual o material começa a se decompor ou reagir e a extensão da mudança de massa usando termogravimetria". Ela acrescenta que "a ausência de reação ou Reação de decomposiçãoUma reação de decomposição é uma reação induzida termicamente de um composto químico que forma produtos sólidos e/ou gasosos. decomposição é usada como uma indicação da Estabilidade térmicaUm material é termicamente estável se não se decompõe sob a influência da temperatura. Uma maneira de determinar a estabilidade térmica de uma substância é usar um TGA (analisador termogravimétrico). estabilidade térmica".
A Figura 1 mostra a curva TGA do ácido acetilsalicílico durante o aquecimento a 600°C em uma atmosfera de nitrogênio.
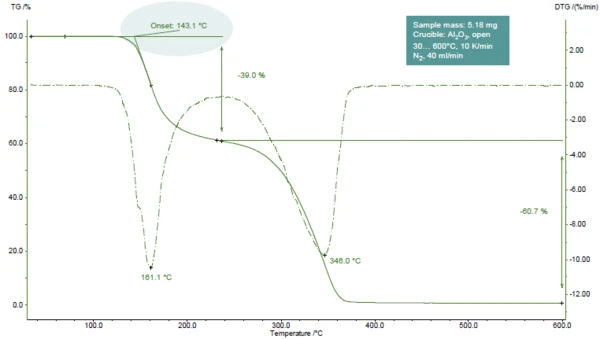
São detectadas duas etapas de perda de massa, facilmente reconhecíveis pelos dois picos na curva DTG (1ª derivada da curva TGA). As investigações de TGA-FT-IR mostraram que, durante a primeira etapa, o ácido acético (parte principal) e o ácido salicílico evoluem. Durante a segunda etapa, o ácido salicílico e oCO2 (resultante da Reação de decomposiçãoUma reação de decomposição é uma reação induzida termicamente de um composto químico que forma produtos sólidos e/ou gasosos. decomposição adicional do ácido acetilsalicílico) são liberados [1].
Cada uma dessas etapas de perda de massa é determinada por:
- temperatura
- a mudança de massa
Teoricamente, três temperaturas podem ser exibidas para uma etapa de perda de massa:
- Temperatura de pico do DTG (1ª derivada da curva TGA)
- Temperatura de início extrapolada de acordo com a norma ISO 11358-1. Esse é "o ponto de interseção da linha de base no início da medição e a tangente à curva TGA no ponto de gradiente máximo"
Temperatura de início de acordo com a norma ASTM E2550. Esse é o "ponto na curva TGA em que uma deflexão é observada pela primeira vez a partir da linha de base estabelecida antes do evento térmico"
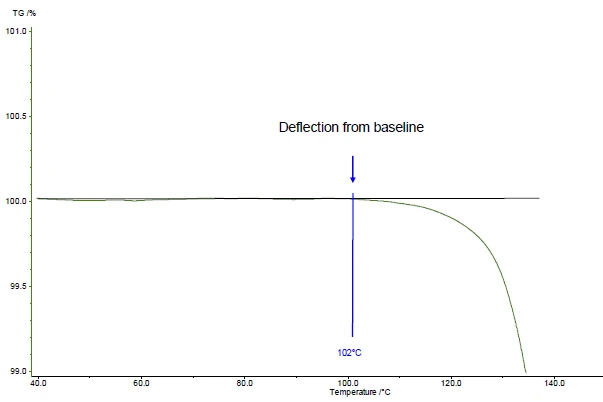
No exemplo apresentado, a primeira etapa de perda de massa ocorre a 161°C (pico da curva DTG, figura 1), a 143°C (temperatura de início extrapolada da curva TGA, figura 1) ou 102°C (temperatura de início de acordo com a ASTM E2550, figura 2). Esse terceiro valor é usado para a avaliação da Estabilidade térmicaUm material é termicamente estável se não se decompõe sob a influência da temperatura. Uma maneira de determinar a estabilidade térmica de uma substância é usar um TGA (analisador termogravimétrico). estabilidade térmica.
O método é limitado a materiais que reagem ou se decompõem na faixa de temperatura investigada e não pode ser usado para sublimação ou VaporizaçãoA vaporização de um elemento ou composto é uma transição de fase do estado líquido para o vapor. Existem dois tipos de vaporização: evaporação e ebulição.vaporização.
Observações sobre as condições de medição:
Como os resultados são afetados pela massa da amostra, pela atmosfera (gás e taxa de fluxo), pela taxa de aquecimento e pelo tipo de cadinho, é fundamental mencionar as condições de medição. Pelo mesmo motivo, os resultados de duas amostras só podem ser comparados se as medições forem realizadas exatamente nas mesmas condições.
Em geral, as seguintes condições de medição são recomendadas:
- Massa da amostra: entre 1 e 10 mg, por exemplo, 5 mg
- Taxa de aquecimento: 10 a 20 K/min (menor para reações energéticas: 1 a 10 K/min)
- Taxa de fluxo da atmosfera: 20 a 100 ml/min
No exemplo apresentado, a Estabilidade térmicaUm material é termicamente estável se não se decompõe sob a influência da temperatura. Uma maneira de determinar a estabilidade térmica de uma substância é usar um TGA (analisador termogravimétrico). estabilidade térmica a 102°C para o ácido acetilsalicílico é dada para uma medição em uma atmosfera dinâmica de nitrogênio (fluxo de gás: 40 ml/min) realizada em uma amostra de 5 mg a uma taxa de aquecimento de 10 K/min (figura 2).
Análise por Neo Cinética
Uma medição termogravimétrica mostra o efeito da temperatura em um material em uma atmosfera específica. Se a perda de massa observada depender da taxa de aquecimento, é possível usar medições de TGA em diferentes taxas de aquecimento para realizar uma análise cinética da reação. Para isso, o site NETZSCH oferece o software Kinetics Neo. Ele permite a modelagem da cinética de reações de uma ou várias etapas. Esse software pode atribuir cada etapa individual a diferentes tipos de reação com parâmetros cinéticos próprios, como energia de ativação, ordem de reação e fator pré-exponencial. Com base nos resultados, o Kinetics Neo é capaz de simular a(s) reação(ões) para programas de temperatura especificados pelo usuário, por exemplo, para isotermas de longa duração. É por isso que as previsões calculadas com o Kinetics Neo fornecem informações sobre o prazo de validade com relação à Estabilidade térmicaUm material é termicamente estável se não se decompõe sob a influência da temperatura. Uma maneira de determinar a estabilidade térmica de uma substância é usar um TGA (analisador termogravimétrico). estabilidade térmica de um material, ou seja, a quantidade de tempo que ele permanece estável sob uma atmosfera e condições de temperatura especificadas.
Um exemplo de determinação do prazo de validade com relação à Estabilidade térmicaUm material é termicamente estável se não se decompõe sob a influência da temperatura. Uma maneira de determinar a estabilidade térmica de uma substância é usar um TGA (analisador termogravimétrico). estabilidade térmica de um produto farmacêutico é explicado na Nota de Aplicação 122 do site NETZSCH [2].
Notas sobre a determinação do prazo de validade de um medicamento com relação à Estabilidade térmicaUm material é termicamente estável se não se decompõe sob a influência da temperatura. Uma maneira de determinar a estabilidade térmica de uma substância é usar um TGA (analisador termogravimétrico). estabilidade térmica:
- Realize medições de TGA em diferentes taxas de aquecimento
- Realize a avaliação cinética com o Kinetics Neo
- Use o modelo cinético determinado para prever o comportamento da amostra para temperaturas e tempos especificados
- Valide o modelo cinético comparando uma medição em uma temperatura isotérmica com a curva calculada pelo Kinetics Neo.
Observações importantes:
- Outros fatores além da temperatura e da atmosfera também influenciam o prazo de validade de um produto, por exemplo, umidade, luz ou perda de miscibilidade no caso de pomadas. É por isso que as previsões realizadas com o TGA e o Kinetics Neo não fornecem informações sobre o prazo de validade completo de um produto, mas apenas sobre seu prazo de validade com relação à Estabilidade térmicaUm material é termicamente estável se não se decompõe sob a influência da temperatura. Uma maneira de determinar a estabilidade térmica de uma substância é usar um TGA (analisador termogravimétrico). estabilidade térmica.
- As previsões são válidas para substâncias que estão no mesmo estado físico na temperatura da previsão e na temperatura do início da Reação de decomposiçãoUma reação de decomposição é uma reação induzida termicamente de um composto químico que forma produtos sólidos e/ou gasosos. decomposição. Se um material estiver em um estado sólido à temperatura ambiente e derreter antes de começar a se decompor, a análise cinética da Reação de decomposiçãoUma reação de decomposição é uma reação induzida termicamente de um composto químico que forma produtos sólidos e/ou gasosos. decomposição será válida somente para o estado líquido. Nesse caso, nenhuma previsão usando o modelo calculado pode ser realizada em temperaturas abaixo do Temperaturas e entalpias de fusãoA entalpia de fusão de uma substância, também conhecida como calor latente, é uma medida da entrada de energia, normalmente calor, necessária para converter uma substância do estado sólido para o líquido. O ponto de fusão de uma substância é a temperatura na qual ela muda de estado, passando do sólido (cristalino) para o líquido (fusão isotrópica).ponto de fusão.
2. Compatibilidade
Em geral, uma formulação farmacêutica contém um ingrediente farmacêutico ativo e vários excipientes.
O ingrediente farmacêutico ativo, também chamado de IFA (Ingrediente Farmacêutico Ativo), é a substância que tem um "efeito direto no diagnóstico, Cura (reações de reticulação)Traduzido literalmente, o termo "crosslinking" significa "rede cruzada". No contexto químico, ele é usado para reações em que as moléculas são unidas por meio da introdução de ligações covalentes e da formação de redes tridimensionais.cura, atenuação, tratamento ou prevenção de doenças" [3].
Há diferentes objetivos para os vários excipientes: eles podem facilitar o processo de fabricação, melhorar a aparência do produto final (cor, sabor) e ajudar o IFA a ser distribuído corretamente.
A presença dos excipientes na formulação não deve afetar a eficácia, a estabilidade ou a segurança do medicamento. Em outras palavras, deve-se garantir que o IFA e os excipientes sejam compatíveis.
As informações iniciais sobre a compatibilidade de um medicamento e excipiente podem ser obtidas com a análise térmica, mais especificamente com DSC e TGA.
Observações sobre a determinação das interações entre o IFA e o excipiente:
- Realize medições de DSC e TGA no IFA e, separadamente, no excipiente
- Misture o IFA e o excipiente (peso 50/50)
- Realize medições de DSC e TGA na mistura de API+excipiente
Curvas DSC de API, excipiente e misturas
A Figura 3 mostra como as curvas DSC fornecem informações sobre uma possível interação entre dois componentes. Uma curva DSC resultante que não mostra interação entre o IFA e o excipiente (Figura 3c) indica que o excipiente é recomendado para a formulação que usa o IFA. A ocorrência de um novo pico na mistura, o desaparecimento de um pico ou uma alteração no pico deTemperaturas e entalpias de fusãoA entalpia de fusão de uma substância, também conhecida como calor latente, é uma medida da entrada de energia, normalmente calor, necessária para converter uma substância do estado sólido para o líquido. O ponto de fusão de uma substância é a temperatura na qual ela muda de estado, passando do sólido (cristalino) para o líquido (fusão isotrópica). fusão (em forma, posição ou entalpia) indicaria que há uma interação entre os dois componentes (figura 3d). Entretanto, isso não significa necessariamente que o medicamento e o excipiente não sejam compatíveis. Investigações adicionais teriam de ser realizadas com outras técnicas (raio X, espectroscopia, cromatografia etc.) para confirmar a incompatibilidade.
c) Curva DSC da mistura API+excipiente SEM interação entre os dois componentes. Um pico deTemperaturas e entalpias de fusãoA entalpia de fusão de uma substância, também conhecida como calor latente, é uma medida da entrada de energia, normalmente calor, necessária para converter uma substância do estado sólido para o líquido. O ponto de fusão de uma substância é a temperatura na qual ela muda de estado, passando do sólido (cristalino) para o líquido (fusão isotrópica). fusão é detectado na mesma temperatura que nas curvas DSC dos componentes individuais. Isso significa que o IFA e o excipiente são compatíveis.
c) Curva DSC da mistura API+excipiente SEM interação entre os dois componentes. Um pico deTemperaturas e entalpias de fusãoA entalpia de fusão de uma substância, também conhecida como calor latente, é uma medida da entrada de energia, normalmente calor, necessária para converter uma substância do estado sólido para o líquido. O ponto de fusão de uma substância é a temperatura na qual ela muda de estado, passando do sólido (cristalino) para o líquido (fusão isotrópica). fusão é detectado na mesma temperatura que nas curvas DSC dos componentes individuais. Isso significa que o IFA e o excipiente são compatíveis.
O recurso de sobreposição do software de avaliação do NETZSCH permite a representação da curva que seria obtida para uma mistura se não houvesse interação entre os dois componentes. Para fazer isso, as curvas das substâncias individuais são carregadas no software de avaliação e a curva "sobreposta" é calculada. Assim, é muito fácil fazer uma comparação entre a curva medida da mistura e a curva calculada por meio da superposição.
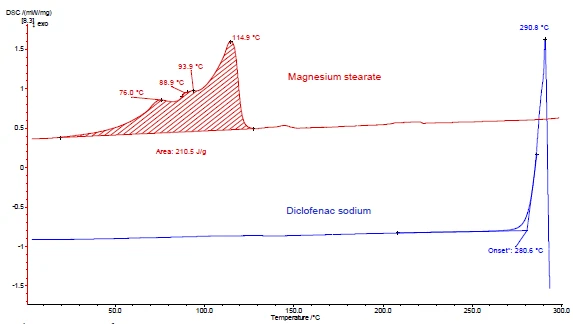
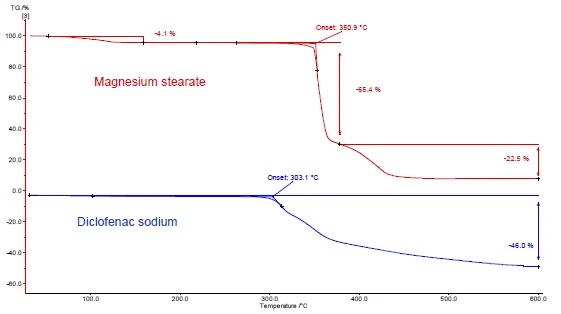
As Figuras 4 e 5 mostram como proceder com o exemplo do diclofenaco de sódio e do estearato de magnésio. Foram realizadas medições de DSC e TGA. As Figuras 4a e 5a exibem as curvas de DSC e TGA, respectivamente, das duas substâncias durante o aquecimento.
O pico EndotérmicoUma transição de amostra ou uma reação é endotérmica se for necessário calor para a conversão.endotérmico entre a temperatura ambiente e 130°C detectado na curva DSC do estearato de magnésio (figura 4a, curva vermelha, parte superior) deve-se em parte à evaporação da água. Ele corresponde a uma perda de massa na curva TGA (4,1%) para essa faixa de temperatura. O pico de liberação de água é sobreposto pela fusão do estearato de magnésio [9].
O diclofenaco de sódio (figura 4a, curva azul, abaixo) mostra um pico EndotérmicoUma transição de amostra ou uma reação é endotérmica se for necessário calor para a conversão.endotérmico a 291°C, correspondente à sua fusão. Um processo ExotérmicoUma transição de amostra ou uma reação é exotérmica se houver geração de calor.exotérmico imediatamente após a fusão está associado a uma perda de massa de 46% e resulta da Reação de decomposiçãoUma reação de decomposição é uma reação induzida termicamente de um composto químico que forma produtos sólidos e/ou gasosos. decomposição do diclofenaco.

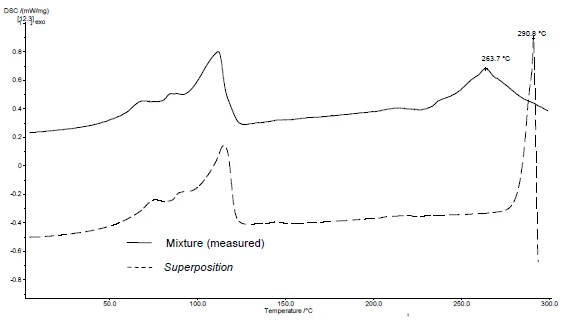

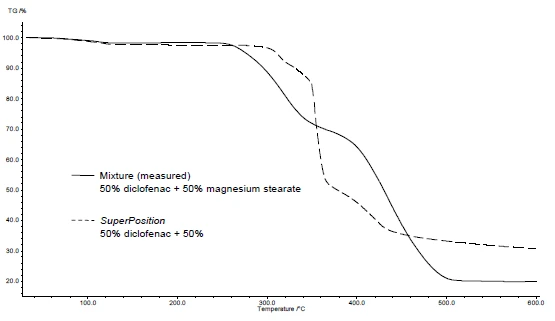
A aplicação do SuperPosition (figuras 4b, 5b) permite a comparação da curva medida da mistura com a curva calculada que seria obtida no caso de nenhuma interação. Nenhuma diferença entre as duas curvas indicaria uma mistura compatível.
Nesse exemplo, a decomposição da mistura começa a 278°C, ou seja, em uma temperatura mais baixa do que a do excipiente sozinho (figura 5c). O pico de fusão típico do diclofenaco não é mais exibido na mistura. Em vez disso, um amplo pico EndotérmicoUma transição de amostra ou uma reação é endotérmica se for necessário calor para a conversão.endotérmico a 264°C é detectado (figura 4c).
O fato de haver diferenças detectadas no exemplo indica que há uma interação entre o diclofenaco de sódio e o estearato de magnésio (figuras 4c e 5c).
Um exemplo adicional de um estudo de compatibilidade do diclofenaco de sódio com diferentes excipientes por meio de DSC e TGA é apresentado na Nota de Aplicação 120 do site NETZSCH [4].
3. Polimorfismo
O PolimorfismoPolimorfismo é a capacidade de um material sólido de formar diferentes estruturas cristalinas (sinônimos: formas, modificações).polimorfismo é a capacidade de um material existir em mais de uma forma cristalina. As diferentes formas polimórficas de uma substância farmacêutica são geralmente chamadas de α, β, ... ou I, II, ... ou A, B, ..., em que a modificação α/I/A é a mais estável.
No setor farmacêutico, o PolimorfismoPolimorfismo é a capacidade de um material sólido de formar diferentes estruturas cristalinas (sinônimos: formas, modificações).polimorfismo é muito desafiador porque, embora duas substâncias polimórficas tenham a mesma composição química, elas diferem em suas propriedades. Como uma substância polimórfica pode mudar sua estrutura ao longo do tempo, podem ocorrer mudanças inesperadas em sua biodisponibilidade, propriedades físicas, estabilidade etc. durante o armazenamento. Por esse motivo, bem como em relação ao registro de patentes, é fundamental estar ciente e conhecer a existência de todas as possíveis modificações de uma substância polimórfica e as propriedades, a estabilidade e a qualidade de cada uma delas.
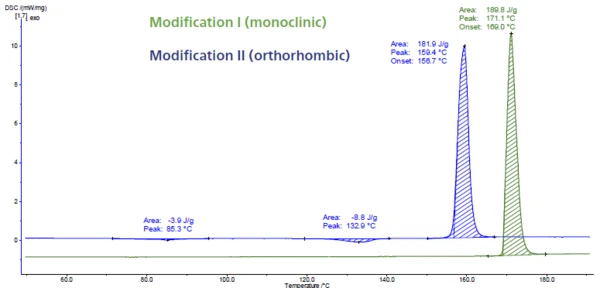
A Figura 6 mostra a medição de DSC do paracetamol. Esse API (Ingrediente Farmacêutico Ativo) tem três modificações denominadas I, II e III. A modificação III é instável e, portanto, difícil de caracterizar. As modificações I e II diferem em suas estabilidades termodinâmicas e em suas capacidades de compressão. Elas podem ser facilmente identificadas por meio de DSC porque aTemperaturas e entalpias de fusãoA entalpia de fusão de uma substância, também conhecida como calor latente, é uma medida da entrada de energia, normalmente calor, necessária para converter uma substância do estado sólido para o líquido. O ponto de fusão de uma substância é a temperatura na qual ela muda de estado, passando do sólido (cristalino) para o líquido (fusão isotrópica). temperatura de fusão é detectada em diferentes temperaturas. O pico de fusão a 169°C (temperatura de início extrapolada, curva verde) é típico da forma monoclínica. Essa é a modificação com o Temperaturas e entalpias de fusãoA entalpia de fusão de uma substância, também conhecida como calor latente, é uma medida da entrada de energia, normalmente calor, necessária para converter uma substância do estado sólido para o líquido. O ponto de fusão de uma substância é a temperatura na qual ela muda de estado, passando do sólido (cristalino) para o líquido (fusão isotrópica).ponto de fusão mais alto e também a mais estável. O pico a 157°C (temperatura de início extrapolada, curva azul) pertence à forma ortorrômbica que apresenta melhores propriedades de compressão [5, 6].
Embora a forma II possa ser comprimida diretamente sem a adição de um excipiente para melhorar a compressibilidade, o paracetamol comercial é fabricado a partir da forma monoclínica (forma I) devido à sua melhor estabilidade [7, 8].
Outros exemplos da caracterização de diferentes modificações de uma substância polimórfica são apresentados na Nota de Aplicação 127 do site NETZSCH [10].
4. Pseudo-polimorfismo
Duas modificações pseudopolimórficas têm diferentes formas de cristal resultantes de hidratação ou solvatação.
Em um solvato, as moléculas de solvente são aprisionadas na estrutura cristalina da substância. Se ela contiver mais de dois solventes, será chamada de hetero-solvato.
Em um hidrato, o solvente em associação com o medicamento é a água.
A caracterização de solvatos e hidratos é realizada com termogravimetria, possivelmente acoplada à análise de gás evoluído. Uma medição de TGA fornece informações sobre a quantidade de solvente/água presente em uma amostra e, portanto, sobre o grau de solvatação/hidratação. O acoplamento permite a identificação de solventes liberados durante o aquecimento.
Conclusão
Por meio da análise térmica, especialmente DSC e TGA, as diferentes propriedades do API e dos excipientes podem ser investigadas. Isso, por sua vez, permite a determinação da Estabilidade térmicaUm material é termicamente estável se não se decompõe sob a influência da temperatura. Uma maneira de determinar a estabilidade térmica de uma substância é usar um TGA (analisador termogravimétrico). estabilidade térmica, da compatibilidade, do PolimorfismoPolimorfismo é a capacidade de um material sólido de formar diferentes estruturas cristalinas (sinônimos: formas, modificações).polimorfismo e do pseudo-PolimorfismoPolimorfismo é a capacidade de um material sólido de formar diferentes estruturas cristalinas (sinônimos: formas, modificações).polimorfismo dos produtos farmacêuticos.