Wprowadzenie
Poniżej wyjaśniono niektóre terminy specyficzne dla branży farmaceutycznej:
- Stabilność termicznaMateriał jest stabilny termicznie, jeśli nie ulega rozkładowi pod wpływem temperatury. Jednym ze sposobów określenia stabilności termicznej substancji jest użycie analizatora termograwimetrycznego (TGA). Stabilność termiczna
- Kompatybilność
- PolimorfizmPolimorfizm to zdolność materiału stałego do tworzenia różnych struktur krystalicznych (synonimy: formy, modyfikacje).Polimorfizm
- Pseudopolimorfizm
1. Stabilność termiczna
Norma ASTM E2550 opisuje stabilność termiczną materiału jako "temperaturę, w której materiał zaczyna się rozkładać lub reagować oraz zakres zmiany masy przy użyciu termograwimetrii". Dodaje, że "brak reakcji lub rozkładu jest wykorzystywany jako wskaźnik stabilności termicznej".
Rysunek 1 przedstawia krzywą TGA kwasu acetylosalicylowego podczas ogrzewania do 600°C w atmosferze azotu.
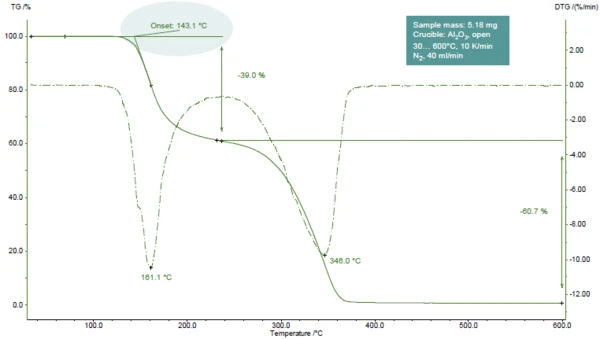
Wykryto dwa etapy utraty masy, łatwo rozpoznawalne przez dwa piki na krzywej DTG (pierwsza pochodna krzywej TGA). Badania TGA-FT-IR wykazały, że podczas pierwszego etapu powstaje kwas octowy (główna część) i kwas salicylowy. Podczas drugiego etapu uwalniany jest kwas salicylowy iCO2 (powstający w wyniku dalszego rozkładu kwasu acetylosalicylowego) [1].
Każdy z tych etapów utraty masy jest określany przez
- temperaturę
- zmianę masy
Teoretycznie można wyświetlić trzy temperatury dla etapu utraty masy:
- Temperatura szczytowa DTG (1. pochodna krzywej TGA)
- Ekstrapolowana temperatura początku zgodnie z normą ISO 11358-1. Jest to "Punkt przecięciaW teście reologicznym, takim jak przemiatanie częstotliwości lub przemiatanie czas/temperatura, punkt przecięcia jest wygodnym punktem odniesienia wskazującym punkt "przejścia" próbki.punkt przecięcia linii bazowej na początku pomiaru i stycznej do krzywej TGA w punkcie maksymalnego gradientu"
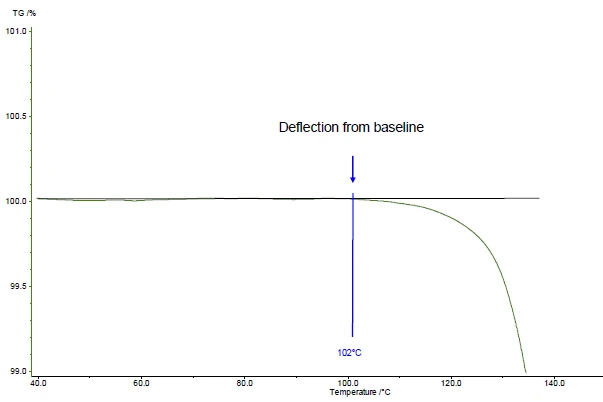
Temperatura początku pomiaru zgodnie z ASTM E2550. Jest to "punkt na krzywej TGA, w którym po raz pierwszy zaobserwowano odchylenie od ustalonej linii bazowej przed zdarzeniem termicznym"
W przedstawionym przykładzie pierwszy etap utraty masy występuje w temperaturze 161°C (szczyt krzywej DTG, rysunek 1), w temperaturze 143°C (ekstrapolowana temperatura początku krzywej TGA, rysunek 1) lub 102°C (temperatura początku zgodnie z ASTM E2550, rysunek 2). Ta trzecia wartość jest wykorzystywana do oceny stabilności termicznej.
Metoda jest ograniczona do materiałów, które reagują lub rozkładają się w badanym zakresie temperatur i nie może być stosowana do sublimacji lub parowania.
Uwagi dotyczące warunków pomiaru:
Ponieważ na wyniki ma wpływ masa próbki, atmosfera (gaz i natężenie przepływu), szybkość ogrzewania i typ tygla, bardzo ważne jest, aby wspomnieć o warunkach pomiaru. Z tego samego powodu wyniki dla dwóch próbek można porównać tylko wtedy, gdy pomiary są przeprowadzane w dokładnie takich samych warunkach.
Ogólnie rzecz biorąc, zalecane są następujące warunki pomiaru:
- Masa próbki: od 1 do 10 mg, na przykład 5 mg
- Szybkość ogrzewania: 10 do 20 K/min (niższa dla reakcji energetycznych: 1 do 10 K/min)
- Natężenie przepływu atmosfery: 20 do 100 ml/min
W przedstawionym przykładzie Stabilność termicznaMateriał jest stabilny termicznie, jeśli nie ulega rozkładowi pod wpływem temperatury. Jednym ze sposobów określenia stabilności termicznej substancji jest użycie analizatora termograwimetrycznego (TGA). stabilność termiczna w temperaturze 102°C dla kwasu acetylosalicylowego jest podana dla pomiaru w dynamicznej atmosferze azotu (przepływ gazu: 40 ml/min) przeprowadzonego na próbce o masie 5 mg przy szybkości ogrzewania 10 K/min (rysunek 2).
Analiza za pomocą Kinetics Neo
Pomiar termograwimetryczny pokazuje wpływ temperatury na materiał w określonej atmosferze. Jeśli obserwowana utrata masy zależy od szybkości ogrzewania, możliwe jest wykorzystanie pomiarów TGA przy różnych szybkościach ogrzewania do przeprowadzenia analizy kinetycznej reakcji. W tym celu NETZSCH oferuje oprogramowanie Kinetics Neo. Umożliwia ono modelowanie kinetyki reakcji jedno- i wieloetapowych. Oprogramowanie to może przypisać każdy etap do różnych typów reakcji z własnymi parametrami kinetycznymi, takimi jak energia aktywacji, kolejność reakcji i współczynnik przedwykładniczy. Na podstawie wyników Kinetics Neo jest w stanie symulować reakcję (reakcje) dla programów temperaturowych określonych przez użytkownika, na przykład dla izoterm długoterminowych. Dlatego prognozy obliczone za pomocą Kinetics Neo dostarczają informacji na temat okresu trwałości w odniesieniu do stabilności termicznej materiału, tj. czasu, przez jaki pozostaje on stabilny w określonej atmosferze i warunkach temperaturowych.
Określanie stabilności termicznej
Przykład wyznaczania okresu trwałości w odniesieniu do stabilności termicznej produktu farmaceutycznego wyjaśniono w nocie aplikacyjnej NETZSCH nr 122 [2].
Uwagi dotyczące określania okresu trwałości leku w odniesieniu do stabilności termicznej:
- Przeprowadzić pomiary TGA przy różnych szybkościach ogrzewania
- Przeprowadzić ocenę kinetyki za pomocą Kinetics Neo
- Wykorzystanie ustalonego modelu kinetycznego do przewidywania zachowania próbki dla określonych temperatur i czasów
- Walidacja modelu kinetycznego poprzez porównanie pomiaru w temperaturze izotermicznej z krzywą obliczoną przez Kinetics Neo.
Ważne uwagi:
- Czynniki inne niż temperatura i atmosfera również wpływają na okres trwałości produktu, np. wilgotność, światło lub utrata mieszalności w przypadku maści. Dlatego też prognozy wykonane za pomocą TGA i Kinetics Neo nie dostarczają informacji o całkowitym okresie trwałości produktu, a jedynie o jego okresie trwałości w odniesieniu do stabilności termicznej.
- Przewidywania są ważne dla substancji, które są w tym samym stanie fizycznym w temperaturze przewidywania i w temperaturze początku rozkładu. Jeśli materiał jest w stanie stałym w temperaturze pokojowej i topi się, zanim zacznie się rozkładać, wówczas analiza kinetyczna rozkładu jest ważna tylko dla stanu ciekłego. W takim przypadku nie można przeprowadzić prognozy przy użyciu obliczonego modelu w temperaturach poniżej temperatury topnienia.
2. Kompatybilność
Ogólnie rzecz biorąc, preparat farmaceutyczny zawiera jeden aktywny składnik farmaceutyczny i kilka substancji pomocniczych.
Aktywny składnik farmaceutyczny, zwany również API (Active Pharmaceutical Ingredient), to substancja, która ma "bezpośredni wpływ na diagnozowanie, leczenie, łagodzenie, leczenie lub zapobieganie chorobom" [3].
Istnieją różne cele dla różnych substancji pomocniczych: mogą one ułatwić proces produkcji, poprawić wygląd produktu końcowego (kolor, smak) i pomóc w prawidłowym dostarczeniu API.
Obecność substancji pomocniczych w formulacji nie powinna wpływać na skuteczność, stabilność lub bezpieczeństwo leku. Innymi słowy, należy upewnić się, że API i substancje pomocnicze są kompatybilne.
Wstępne informacje na temat kompatybilności leku i substancji pomocniczej można uzyskać za pomocą analizy termicznej, a dokładniej za pomocą DSC i TGA.
Uwagi dotyczące określania interakcji API i substancji pomocniczej:
- Przeprowadzić pomiary DSC i TGA na API i, oddzielnie, na substancji pomocniczej
- Wymieszać API i substancję pomocniczą (50/50 wagowo)
- Przeprowadzić pomiary DSC i TGA na mieszaninie API+zaróbka
Krzywe DSC substancji czynnej, substancji pomocniczej i mieszanin
Rysunek 3 pokazuje, w jaki sposób krzywe DSC dostarczają informacji o potencjalnej interakcji między dwoma składnikami. Wynikowa krzywa DSC, która nie wykazuje interakcji między API i zaróbką (rysunek 3c) wskazuje, że zaróbka jest zalecana do formulacji z użyciem API. Pojawienie się nowego piku w mieszaninie, zniknięcie piku lub zmiana piku topnienia (w kształcie, położeniu lub entalpii) wskazywałoby na interakcję między dwoma składnikami (rysunek 3d). Nie musi to jednak oznaczać, że lek i zaróbka nie są kompatybilne. W celu potwierdzenia niezgodności konieczne byłoby przeprowadzenie dodatkowych badań z wykorzystaniem innych technik (rentgenografii, spektroskopii, chromatografii itp.).
a) Krzywa DSC API z pikiem topnienia

b) Krzywa DSC substancji pomocniczej z pikiem topnienia
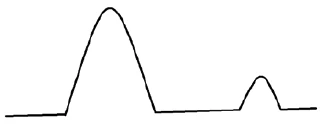
c) Krzywa DSC mieszaniny API + substancja pomocnicza BEZ interakcji między tymi dwoma składnikami. Jeden pik topnienia jest wykrywany w tej samej temperaturze, co na krzywych DSC dla poszczególnych składników. Oznacza to, że API i zaróbka są kompatybilne.
c) Krzywa DSC mieszaniny API + substancja pomocnicza BEZ interakcji między tymi dwoma składnikami. Jeden pik topnienia jest wykrywany w tej samej temperaturze, co na krzywych DSC dla poszczególnych składników. Oznacza to, że API i zaróbka są kompatybilne.
Funkcja superpozycji w oprogramowaniu do oceny NETZSCH umożliwia przedstawienie krzywej, która zostałaby uzyskana dla mieszaniny, gdyby nie wystąpiła interakcja między dwoma składnikami. Aby to zrobić, krzywe poszczególnych substancji są ładowane do oprogramowania oceniającego i obliczana jest "nałożona" krzywa. Następnie bardzo łatwo jest porównać zmierzoną krzywą mieszaniny z krzywą obliczoną za pomocą superpozycji.
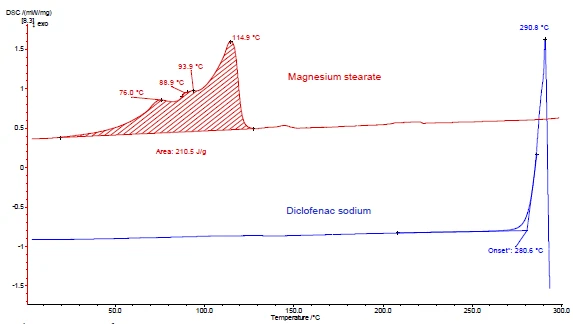
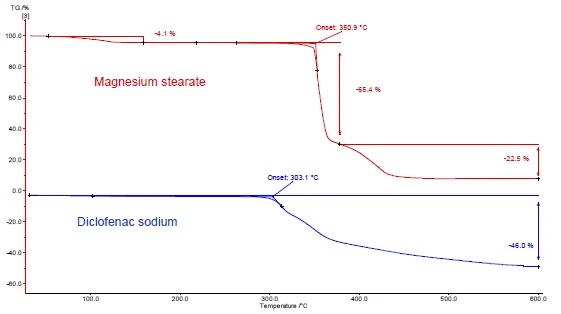
Rysunki 4 i 5 pokazują, jak postępować na przykładzie diklofenaku sodu i stearynianu magnezu. Przeprowadzono pomiary DSC i TGA. Rysunki 4a i 5a przedstawiają odpowiednio krzywe DSC i TGA dwóch substancji podczas ogrzewania.
Pik EndotermicznyPrzemiana próbki lub reakcja jest endotermiczna, jeśli do konwersji potrzebne jest ciepło.endotermiczny między temperaturą pokojową a 130°C wykryty na krzywej DSC stearynianu magnezu (rysunek 4a, czerwona krzywa, góra) jest częściowo spowodowany odparowaniem wody. Odpowiada to utracie masy na krzywej TGA (4,1%) dla tego zakresu temperatur. Pik uwalniania wody pokrywa się z topnieniem stearynianu magnezu [9].
Diklofenak sodowy (rysunek 4a, niebieska krzywa, poniżej) wykazuje pik EndotermicznyPrzemiana próbki lub reakcja jest endotermiczna, jeśli do konwersji potrzebne jest ciepło.endotermiczny w temperaturze 291°C, odpowiadający jego topnieniu. Proces EgzotermicznyPrzejście próbki lub reakcja jest egzotermiczna, jeśli generowane jest ciepło.egzotermiczny następujący bezpośrednio po topnieniu jest związany z utratą masy 46% i wynika z rozkładu diklofenaku.

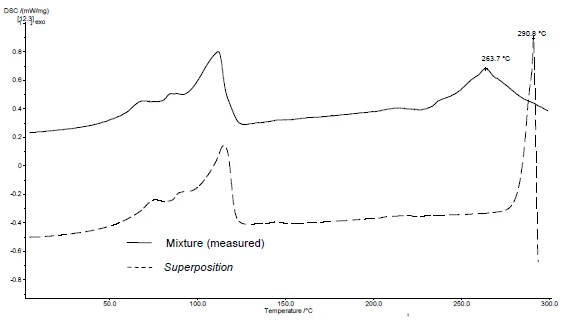

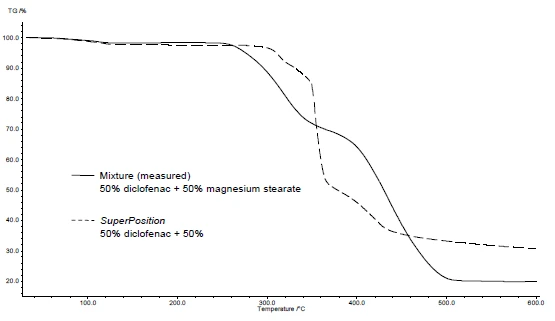
Zastosowanie SuperPosition (rysunki 4b, 5b) pozwala na porównanie zmierzonej krzywej mieszaniny z obliczoną krzywą, która zostałaby uzyskana w przypadku braku interakcji. Brak różnicy między tymi dwiema krzywymi wskazywałby na zgodność mieszaniny.
W tym przykładzieReakcja rozkładuReakcja rozkładu to wywołana termicznie reakcja związku chemicznego tworząca produkty stałe i/lub gazowe. rozkład mieszaniny rozpoczyna się w temperaturze 278°C, tj. w niższej temperaturze niż w przypadku samej substancji pomocniczej (rysunek 5c). Pik topnienia typowy dla diklofenaku nie jest już widoczny w mieszaninie. Zamiast tego wykrywany jest szeroki pik EndotermicznyPrzemiana próbki lub reakcja jest endotermiczna, jeśli do konwersji potrzebne jest ciepło.endotermiczny w temperaturze 264°C (rysunek 4c).
Fakt, że w tym przykładzie wykryto różnice, wskazuje, że istnieje interakcja między diklofenakiem sodowym a stearynianem magnezu (rysunki 4c i 5c).
Kolejny przykład badania kompatybilności diklofenaku sodowego z różnymi substancjami pomocniczymi za pomocą DSC i TGA podano w nocie aplikacyjnej 120 NETZSCH [4].
3. Polimorfizm
PolimorfizmPolimorfizm to zdolność materiału stałego do tworzenia różnych struktur krystalicznych (synonimy: formy, modyfikacje).Polimorfizm to zdolność materiału do występowania w więcej niż jednej formie krystalicznej. Różne formy polimorficzne substancji farmaceutycznej są zwykle nazywane α, β, ... lub I, II, ... lub A, B, ..., gdzie modyfikacja α/I/A jest najbardziej stabilna.
W przemyśle farmaceutycznym PolimorfizmPolimorfizm to zdolność materiału stałego do tworzenia różnych struktur krystalicznych (synonimy: formy, modyfikacje).polimorfizm jest bardzo trudny, ponieważ nawet jeśli dwie substancje polimorficzne mają ten sam skład chemiczny, różnią się właściwościami. Ponieważ substancja polimorficzna może z czasem zmieniać swoją strukturę, podczas przechowywania mogą wystąpić nieoczekiwane zmiany w jej biodostępności, właściwościach fizycznych, stabilności itp. Z tego powodu, a także w związku z rejestracją patentową, kluczowe znaczenie ma świadomość i wiedza na temat istnienia wszystkich potencjalnych modyfikacji substancji polimorficznej oraz właściwości, stabilności i jakości każdej z nich.
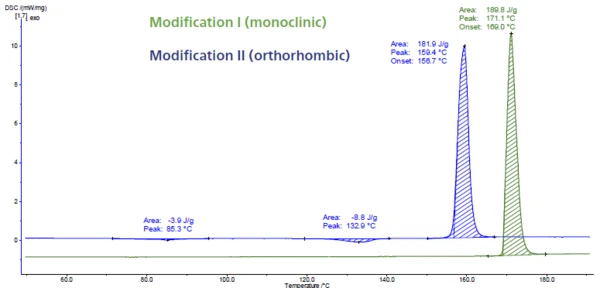
Rysunek 6 przedstawia pomiar DSC paracetamolu. Ten API (aktywny składnik farmaceutyczny) ma trzy modyfikacje zwane I, II i III. Modyfikacja III jest niestabilna, a zatem trudna do scharakteryzowania. Modyfikacje I i II różnią się stabilnością termodynamiczną i zdolnością do kompresji. Można je łatwo zidentyfikować za pomocą DSC, ponieważ Temperatury i entalpie topnieniaEntalpia syntezy substancji, znana również jako ciepło utajone, jest miarą nakładu energii, zazwyczaj ciepła, która jest niezbędna do przekształcenia substancji ze stanu stałego w ciekły. Temperatura topnienia substancji to temperatura, w której zmienia ona stan ze stałego (krystalicznego) na ciekły (stopiony izotropowo).temperatura topnienia jest wykrywana w różnych temperaturach. Pik topnienia w temperaturze 169°C (ekstrapolowana temperatura początku, zielona krzywa) jest typowy dla formy jednoskośnej. Jest to modyfikacja o najwyższej temperaturze topnienia, a także najbardziej stabilna. Pik w temperaturze 157°C (ekstrapolowana temperatura początku, krzywa niebieska) należy do formy ortorombowej, która charakteryzuje się lepszymi właściwościami ściskania [5, 6].
Chociaż forma II może być bezpośrednio prasowana bez dodatku substancji pomocniczej w celu poprawy ściśliwości, komercyjny paracetamol jest wytwarzany z formy jednoskośnej (forma I) ze względu na jej lepszą stabilność [7, 8].
Inne przykłady charakterystyki różnych modyfikacji substancji polimorficznej podano w nocie aplikacyjnej NETZSCH 127 [10].
4. Pseudopolimorfizm
Dwie modyfikacje pseudopolimorficzne mają różne formy krystaliczne wynikające z hydratacji lub solwatacji.
W solwacie cząsteczki rozpuszczalnika są uwięzione w strukturze krystalicznej substancji. Jeśli zawiera on więcej niż dwa rozpuszczalniki, nazywany jest heterosolwatem.
W hydracie rozpuszczalnikiem w połączeniu z lekiem jest woda.
Charakterystykę solwatów i hydratów przeprowadza się za pomocą termograwimetrii, ewentualnie w połączeniu z analizą gazu ulatniającego się. Pomiar TGA dostarcza informacji o ilości rozpuszczalnika/wody obecnej w próbce, a tym samym o stopniu solwatacji/hydratacji. Sprzężenie pozwala na identyfikację rozpuszczalników uwalnianych podczas ogrzewania.
Wnioski
Za pomocą analizy termicznej, w szczególności DSC i TGA, można badać różne właściwości API i substancji pomocniczych. To z kolei pozwala na określenie stabilności termicznej, kompatybilności oraz polimorfizmu i pseudopolimorfizmu farmaceutyków.