مقدمة
فيما يلي شرح لبعض المصطلحات الخاصة بالمجال الصيدلاني:
- الثبات الحراري
- التوافق
- تعدد الأشكال
- تعدد الأشكال الزائف
1. الاستقرار الحراري
وتصف المواصفة القياسية ASTM E2550 الاستقرار الحراري للمادة بأنه "درجة الحرارة التي تبدأ عندها المادة في التحلل أو التفاعل ومدى تغير الكتلة باستخدام قياس الثبات الحراري". وتضيف أن "غياب التفاعل أو التحلل يستخدم كمؤشر على الثبات الحراري".
ويعرض الشكل 1 منحنى TGA لحمض أسيتيل الساليسيليك أثناء التسخين إلى 600 درجة مئوية في جو من النيتروجين.
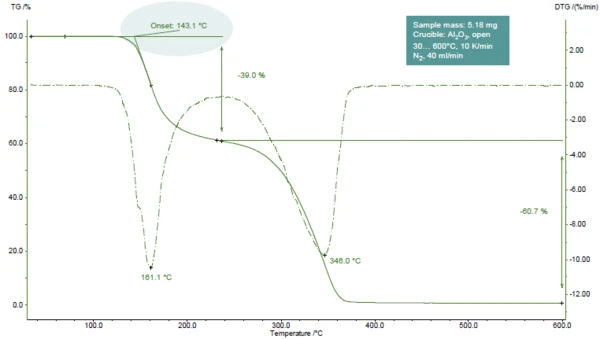
تم الكشف عن خطوتين لفقدان الكتلة، ويمكن التعرف عليهما بسهولة من خلال القمتين في منحنى DTG (المشتقالأول لمنحنى TGA). أظهرت تحقيقات TGA-FT-IR أنه خلال الخطوة الأولى، يتطور حمض الأسيتيك (الجزء الرئيسي) وحمض الساليسيليك. وخلال الخطوة الثانية، يتم إطلاق حمض الساليسيليك وثاني أكسيد الكربون (الناتج عن التحلل الإضافي لحمض أسيتيل الساليسيليك) [1].
يتم تحديد كل خطوة من خطوات فقدان الكتلة هذه من خلال:
- درجة الحرارة
- تغير الكتلة
نظريًا، يمكن عرض ثلاث درجات حرارة لخطوة فقدان الكتلة:
- درجة حرارة الذروة لـ DTG (المشتق الأول لمنحنى TGA)
- درجة حرارة البداية المستنبطة وفقًا للمعيار ISO 11358-1 ISO 11358-1. هذه هي "نقطة تقاطع خط الأساس في بداية القياس والمماس لمنحنى TGA عند نقطة التدرج الأقصى"
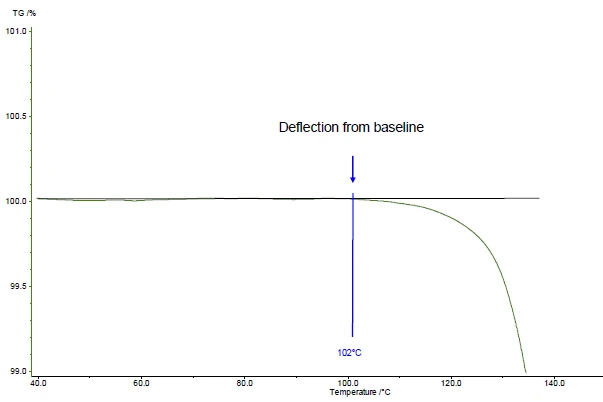
درجة حرارة البداية وفقًا للمعيار ASTM E2550. هذه هي "النقطة في منحنى TGA حيث لوحظ أول انحراف عن خط الأساس المحدد قبل الحدث الحراري"
في المثال المعروض، تحدث الخطوة الأولى لفقدان الكتلة عند 161 درجة مئوية (ذروة منحنى TGA، الشكل 1)، أو عند 143 درجة مئوية (درجة حرارة البداية المستنبطة لمنحنى TGA، الشكل 1) أو 102 درجة مئوية (درجة حرارة البداية وفقًا للمعيار ASTM E2550، الشكل 2). تُستخدم هذه القيمة الثالثة لتقييم الثبات الحراري.
وتقتصر هذه الطريقة على المواد التي تتفاعل أو تتحلل في نطاق درجة الحرارة المدروسة، ولا يمكن استخدامها في التسامي أو التبخير.
ملاحظات بشأن ظروف القياس:
نظرًا لأن النتائج تتأثر بكتلة العينة، والغلاف الجوي (الغاز ومعدل التدفق)، ومعدل التسخين ونوع البوتقة، فمن الضروري ذكر ظروف القياس. وللسبب نفسه، لا يمكن مقارنة النتائج لعينتين إلا إذا تم إجراء القياسات في نفس الظروف بالضبط.
بشكل عام، يوصى بشروط القياس التالية:
- كتلة العينة: بين 1 و10 ملجم، على سبيل المثال، 5 ملجم
- معدل التسخين: من 10 إلى 20 كلفن/الدقيقة (أقل للتفاعلات النشطة: من 1 إلى 10 كلفن/الدقيقة)
- معدل تدفق الغلاف الجوي: 20 إلى 100 مل/دقيقة
في المثال المعروض، تم إعطاء الثبات الحراري عند درجة حرارة 102 درجة مئوية لحمض أسيتيل الساليسيليك للقياس في جو نيتروجين ديناميكي (تدفق الغاز: 40 مل/دقيقة) الذي تم إجراؤه على عينة 5 ملغم بمعدل تسخين 10 كلفن/دقيقة (الشكل 2).
الاستقرار الحراري ومدة الصلاحية
التحليل بواسطة حركية نيو
يُظهر قياس قياس الثبات الحراري بالحرارة تأثير درجة الحرارة على مادة ما في جو محدد. إذا كان فقدان الكتلة الملحوظ يعتمد على معدل التسخين، فمن الممكن استخدام قياسات TGA بمعدلات تسخين مختلفة لإجراء تحليل حركي للتفاعل. ولهذا الغرض، تقدم NETZSCH برنامج Kinetics Neo. وهو يسمح بنمذجة حركية التفاعلات أحادية إلى متعددة الخطوات. يمكن لهذا البرنامج تعيين كل خطوة على حدة لأنواع مختلفة من التفاعلات مع معلمات حركية خاصة بها، مثل طاقة التنشيط وترتيب التفاعل والعامل الأسي المسبق. واستنادًا إلى النتائج، يستطيع برنامج Kinetics Neo محاكاة التفاعل (التفاعلات) لبرامج درجات الحرارة التي يحددها المستخدم، على سبيل المثال متساوي الحرارة لفترة طويلة. ولهذا السبب فإن التنبؤات المحسوبة باستخدام Kinetics Neo تعطي معلومات حول العمر الافتراضي فيما يتعلق بالثبات الحراري للمادة، أي مقدار الوقت الذي تظل فيه مستقرة في ظل ظروف جو ودرجة حرارة محددة.
تحديد الثبات الحراري
يتم شرح مثال على تحديد فترة الصلاحية فيما يتعلق بالثبات الحراري للمنتج الصيدلاني في الملاحظة التطبيقية NETZSCH 122 [2].
ملاحظات بشأن تحديد العمر الافتراضي للدواء فيما يتعلق بالثبات الحراري:
- إجراء قياسات TGA بمعدلات تسخين مختلفة
- إجراء تقييم الحركية باستخدام Kinetics Neo
- استخدام نموذج الحركية المحدد للتنبؤ بسلوك العينة لدرجات الحرارة والأوقات المحددة
- التحقق من صحة النموذج الحركي من خلال مقارنة القياس عند درجة حرارة متساوية مع المنحنى المحسوب بواسطة Kinetics Neo.
ملاحظات مهمة:
- تؤثر عوامل أخرى غير درجة الحرارة والغلاف الجوي أيضًا على العمر الافتراضي للمنتج، على سبيل المثال، الرطوبة أو الضوء أو فقدان القابلية للامتزاج في حالة المراهم. وهذا هو السبب في أن التنبؤات التي يتم إجراؤها باستخدام TGA وKinetics Neo لا تعطي معلومات حول العمر الافتراضي الكامل للمنتج، ولكن فقط حول العمر الافتراضي فيما يتعلق بالثبات الحراري.
- تكون التنبؤات صالحة للمواد التي تكون في نفس الحالة الفيزيائية عند درجة حرارة التنبؤ ودرجة حرارة بداية التحلل. إذا كانت المادة في حالة صلبة في درجة حرارة الغرفة وذابت قبل أن تبدأ في التحلل، فإن التحليل الحركي للتحلل يكون صالحًا فقط للحالة السائلة. في هذه الحالة، لا يمكن إجراء أي تنبؤ باستخدام النموذج المحسوب عند درجات حرارة أقل من درجة الانصهار.
2. التوافق
بشكل عام، تحتوي التركيبة الصيدلانية على مكون صيدلاني نشط واحد والعديد من السواغات.
المكوّن الصيدلاني النشط، الذي يُطلق عليه أيضًا اسم API (المكون الصيدلاني النشط)، هو المادة التي لها "تأثير مباشر على تشخيص المرض أو علاجه أو تخفيفه أو علاجه أو الوقاية منه" [3].
هناك أهداف مختلفة لمختلف السواغات: يمكنها تسهيل عملية التصنيع وتحسين مظهر المنتج النهائي (اللون والطعم) والمساعدة في توصيل المكون الصيدلاني الفعال بشكل صحيح.
يجب ألا يؤثر وجود السواغات في التركيبة على فعالية الدواء أو ثباته أو سلامته. وبعبارة أخرى، يجب التأكد من توافق المكون الصيدلاني الصيدلاني النشط والسواغات.
يمكن الحصول على معلومات أولية حول توافق الدواء والسواغات من خلال التحليل الحراري، وبشكل أكثر تحديدًا باستخدام DSC وTGA.
ملاحظات بشأن تحديد التفاعلات على المكون الصيدلاني النشط والسواغ:
- قم بإجراء قياسات DSC وTGA على المكون الصيدلاني النشط، وبشكل منفصل على السواغ
- خلط المكون الصيدلاني النشط والساغ (الوزن 50/50)
- قم بإجراء قياس DSC وTGA على خليط المكون الصيدلاني النشط + السواغ (API)
منحنيات DSC للمكونات الفعالة الفعالة والمكونات السائبة والمخاليط
يوضح الشكل 3 كيف تعطي منحنيات DSC معلومات عن التفاعل المحتمل بين مكونين. يشير منحنى DSC الناتج الذي لا يُظهر أي تفاعل بين المكون الصيدلاني النشط والمادة السائغة (الشكل 3 ج) إلى أن المادة السائغة موصى بها للتركيبة التي تستخدم المكون الصيدلاني النشط. قد يشير حدوث قمة جديدة في الخليط أو اختفاء قمة أو تغير في قمة الذوبان (في الشكل أو الموضع أو الإنثالبي) إلى وجود تفاعل بين المكونين (الشكل 3د). ومع ذلك، هذا لا يعني بالضرورة أن الدواء والسواغ غير متوافقين. يجب إجراء فحوصات إضافية باستخدام تقنيات أخرى (الأشعة السينية والتحليل الطيفي والتحليل اللوني وما إلى ذلك) لتأكيد عدم التوافق.
أ) منحنى DSC لـ API مع ذروة الانصهار

ب) منحنى DSC للسواغ مع ذروة الانصهار
ج) منحنى التذبذب الحراري المغناطيسي الحراري DSC لمزيج المكون النشط الفعال + المادة الفعالة المكونة بدون تفاعل بين المكونين. تم اكتشاف قمة ذوبان واحدة عند نفس درجة الحرارة كما في منحنيات DSC للمكونات المنفردة. وهذا يعني أن المكون الصيدلاني النشط API والسواغ متوافقان.
ج) منحنى التذبذب الحراري المغناطيسي الحراري DSC لمزيج المكون النشط الفعال + المادة الفعالة المكونة بدون تفاعل بين المكونين. تم اكتشاف قمة ذوبان واحدة عند نفس درجة الحرارة كما في منحنيات DSC للمكونات المنفردة. وهذا يعني أن المكون الصيدلاني النشط API والسواغ متوافقان.
تسمح خاصية التراكب في برنامج التقييم من NETZSCH بتصوير المنحنى الذي يمكن الحصول عليه لمخلوط ما في حالة عدم حدوث تفاعل بين المكونين. لتنفيذ ذلك، يتم تحميل منحنيات المواد المنفردة في برنامج التقييم، ويتم حساب المنحنى "المتراكب". ومن ثم يكون من السهل جدًا إجراء مقارنة بين المنحنى المقاس للمخلوط والمنحنى المحسوب عن طريق التراكب.
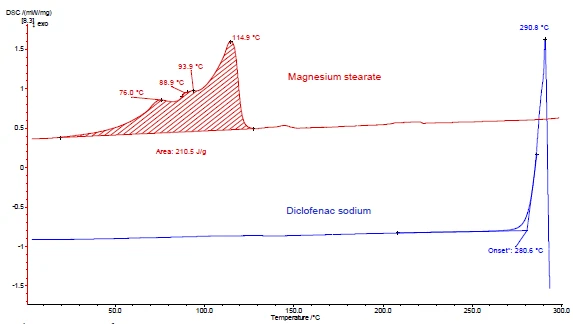
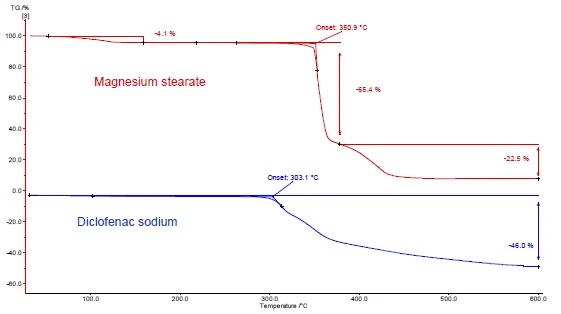
يوضح الشكلان 4 و5 كيفية المتابعة مع مثال ديكلوفيناك الصوديوم وستيرات المغنيسيوم. أُجريت قياسات DSC وTGA. يعرض الشكلان 4أ و5أ منحنيات DSC وTGA، على التوالي، للمادتين أثناء التسخين.
وتُعزى الذروة الحرارية الداخلية بين درجة حرارة الغرفة و130 درجة مئوية المكتشفة في منحنى DSC لستيرات المغنيسيوم (الشكل 4أ، المنحنى الأحمر، في الأعلى) جزئيًا إلى تبخر الماء. وهو يتوافق مع فقدان الكتلة في منحنى TGA (4.1%) لهذا النطاق من درجات الحرارة. تتداخل ذروة إطلاق الماء مع ذوبان ستيرات المغنيسيوم [9].
يُظهر ديكلوفيناك الصوديوم (الشكل 4 أ، المنحنى الأزرق، أدناه) ذروة ماصة للحرارة عند 291 درجة مئوية، وهو ما يقابل ذوبانه. ترتبط العملية الطاردة للحرارة التي تلي الذوبان مباشرةً بفقدان الكتلة بنسبة 46% وتنتج عن تحلل الديكلوفيناك.

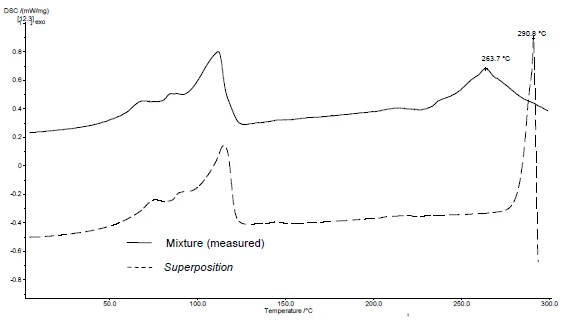

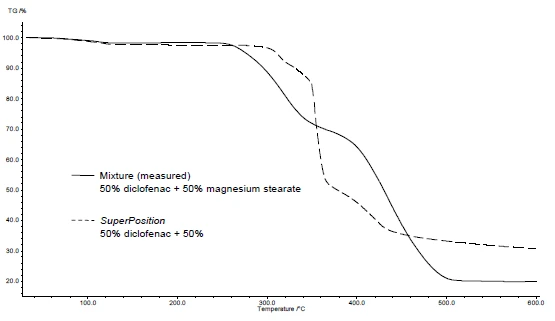
يسمح تطبيق SuperPosition (الشكلان 4 ب، 5 ب) بمقارنة المنحنى المقيس للمخلوط مع المنحنى المحسوب الذي يمكن الحصول عليه في حالة عدم وجود تفاعل. يشير عدم وجود فرق بين المنحنيين إلى وجود خليط متوافق.
في هذا المثال، يبدأ تحلل الخليط عند درجة حرارة 278 درجة مئوية، أي عند درجة حرارة أقل من درجة حرارة السواغ وحده (الشكل 5 ج). لم تعد ذروة الذوبان النموذجية للديكلوفيناك تظهر في الخليط. وبدلاً من ذلك، تم اكتشاف ذروة انصهار واسعة عند 264 درجة مئوية (الشكل 4ج).
تشير حقيقة أن هناك اختلافات تم اكتشافها في المثال إلى وجود تفاعل بين ديكلوفيناك الصوديوم وستيرات المغنيسيوم (الشكلان 4ج و5ج).
ويرد مثال آخر لدراسة التوافق على ديكلوفيناك الصوديوم مع سواغات مختلفة عن طريق DSC وTGA في الملاحظة التطبيقية NETZSCH 120 [4].
3. تعدد الأشكال
تعدد الأشكال هو قدرة المادة على الوجود في أكثر من شكل بلوري واحد. عادةً ما تسمى الأشكال المتعددة الأشكال المختلفة لمادة صيدلانية ما α، ... أو I، II، ... أو A، B، ... أو A، B، ...، حيث يكون التعديل α/I/A هو الأكثر استقراراً.
في صناعة المستحضرات الصيدلانية، يمثل تعدد الأشكال تحديًا كبيرًا لأنه على الرغم من أن مادتين متعددتي الأشكال لهما نفس التركيب الكيميائي، إلا أنهما تختلفان في خصائصهما. نظرًا لأن المادة متعددة الأشكال يمكن أن تغير تركيبها بمرور الوقت، يمكن أن تحدث تغيرات غير متوقعة في توافرها الحيوي وخصائصها الفيزيائية وثباتها وما إلى ذلك أثناء التخزين. لهذا السبب، وكذلك فيما يتعلق بتسجيل براءة الاختراع، من المهم أن تكون على دراية ومعرفة بوجود جميع التعديلات المحتملة للمادة متعددة الأشكال وخصائص وثبات وجودة كل منها.
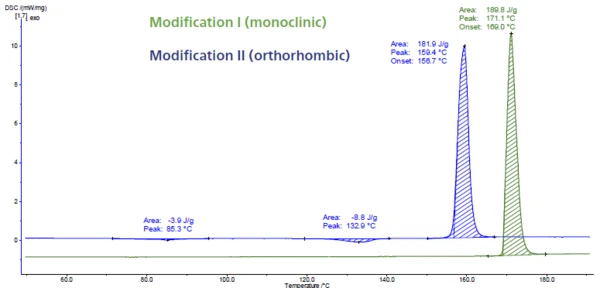
يعرض الشكل 6 قياس DSC على الباراسيتامول. يحتوي هذا المكون الصيدلاني الفعال (API) على ثلاثة تعديلات تسمى الأول والثاني والثالث. التعديل الثالث غير مستقر وبالتالي يصعب توصيفه. ويختلف التعديلان الأول والثاني في ثباتهما الديناميكي الحراري وقدراتهما على الضغط. يمكن تحديدها بسهولة عن طريق DSC لأنه يتم اكتشاف درجة حرارة الذوبان عند درجات حرارة مختلفة. تُعد ذروة الانصهار عند 169 درجة مئوية (درجة حرارة البداية المستنبطة، المنحنى الأخضر) نموذجية للشكل الأحادي. إنه التعديل ذو أعلى نقطة انصهار وأيضًا الأكثر استقرارًا. تنتمي الذروة عند 157 درجة مئوية (درجة حرارة البداية المستقراة، المنحنى الأزرق) إلى الشكل التقويمي الذي يتميز بخصائص ضغط أفضل [5، 6].
على الرغم من أن الشكل الثاني يمكن ضغطه مباشرةً دون إضافة سواغ لتحسين قابلية الانضغاط، إلا أن الباراسيتامول التجاري يتم تصنيعه من الشكل الأحادي (الشكل الأول) بسبب ثباته الأفضل [7، 8].
وترد أمثلة أخرى لتوصيف التعديلات المختلفة لمادة متعددة الأشكال في الملاحظة التطبيقية NETZSCH 127 [10].
4. تعدد الأشكال الزائف
هناك تعديلان شبه متعدد الأشكال لهما أشكال بلورية مختلفة ناتجة عن الإماهة أو الإذابة.
في المذاب، تنحصر جزيئات المذيب في التركيب البلوري للمادة. إذا كان هذا يحتوي على أكثر من مذيبين، فيُشار إليه بالمذيبات المتغايرة.
في الهيدرات، يكون المذيب المرتبط بالدواء هو الماء.
يتم إجراء توصيف المذيبات والهيدرات باستخدام قياس الثقل الحراري، وربما يقترن بتحليل الغاز المتطور. يوفر قياس TGA معلومات حول كمية المذيب/الماء الموجودة في العينة، وبالتالي حول درجة الذوبان/الإماهة. يسمح الاقتران بتحديد المذيبات المنطلقة أثناء التسخين.
الخاتمة
عن طريق التحليل الحراري، وخاصةً DSC وTGA، يمكن دراسة الخصائص المختلفة للمكونات الصيدلانية الفعالة والسواغات. ويسمح هذا بدوره بتحديد الثبات الحراري والتوافق وتعدد الأشكال وتعدد الأشكال الزائف للمستحضرات الصيدلانية.