Einleitung
Im Folgenden werden einige pharmaspezifische Begriffe
erläutert:
- Thermische StabilitätEin Material ist thermisch stabil, wenn es sich unter Temperatureinfluss nicht zersetzt. Eine Möglichkeit, die thermische Stabilität einer Substanz zu bestimmen ist die Verwendung eines TGA (thermogravimetrischer Analysator).Thermische Stabilität
- Kompatibilität
- PolymorphiePolymorphie ist die Fähigkeit eines festen Materials, verschiedene kristalline Strukturen (Synonym: Formen, Modifikationen) auszubilden.Polymorphie
- Pseudopolymorphie
1. Thermische Stabilität
In der Norm ASTM E2550 wird die Thermische StabilitätEin Material ist thermisch stabil, wenn es sich unter Temperatureinfluss nicht zersetzt. Eine Möglichkeit, die thermische Stabilität einer Substanz zu bestimmen ist die Verwendung eines TGA (thermogravimetrischer Analysator).thermische Stabilität eines Materials als “Temperatur, bei der die Zersetzung oder Reaktion des Materials einsetzt sowie das Ausmaß der Massenänderung mittels Thermogravimetrie” beschrieben. Ergänzend steht, dass „das Ausbleiben einer Reaktion oder einer Zersetzung als Indikator für die thermische Stabilität herangezogen wird”.
Abbildung 1 zeigt die TG-Kurve von Acetylsalicylsäure während der Aufheizung bis 600 °C.
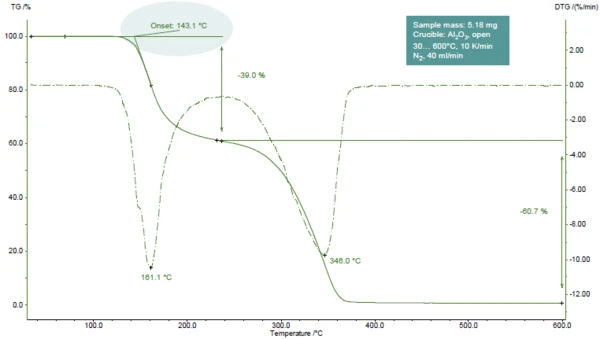
Es werden zwei Massenverluststufen detektiert, die an den beiden Peaks in der DTG-Kurve (1. Ableitung der TG-Kurve) leicht erkennbar sind. TG-FT-IR-Untersuchungen zeigten, dass während der ersten Stufe Essigsäure (Hauptteil) und Salicylsäure verdampfen. Während der zweiten Stufe werden Salicylsäure und CO2 (als Ergebnis der weiteren Zersetzung der Acetylsalicylsäure) freigesetzt [1].
Jeder dieser Massenverluststufen wird bestimmt durch
- die Temperatur
- die Massenänderung
Theoretisch können für eine Massenverluststufe drei Temperaturen angezeigt werden:
- Peaktemperatur der DTG (1. Ableitung der TG-Kurve)
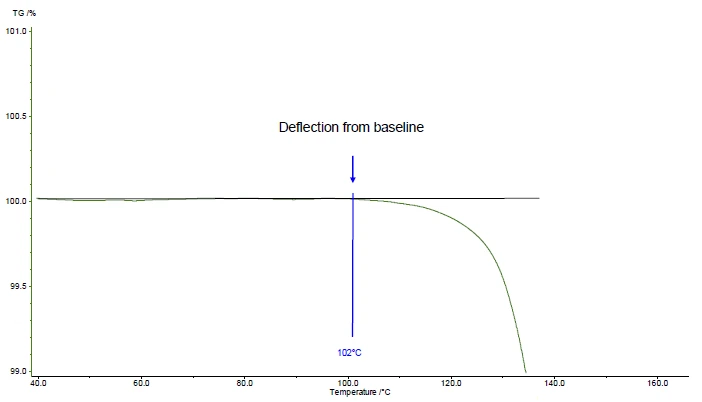
- Extrapolierte Onsettemperatur gemäß der Norm ISO 11358-1. Dies ist der „Schnittpunkt der Basislinie zu Beginn der Messung und der Tangente zur TG-Kurve zum Zeitpunkt des maximalen Gradienten”
- Onsettemperatur gemäß ASTM E2550. Dies ist der „Punkt in der TG-Kurve, bei dem vor dem thermischen Ereignis zunächst eine Abweichung von der festgelegten Basislinie beobachtet wird”
Im vorliegenden Beispiel tritt die erste Massenverluststufen
- bei 161°C (Peak der DTG-Kurve, Abbildung 1),
- bei 143 °C (extrapolierter Onset der TG-Kurve, Abbildung 1) oder
- bei 102 °C (Onsettemperatur gemäß ASTM E2550, Abbildung 2) auf.
Dieser dritte Wert wird zur Auswertung der thermischen Stabilität herangezogen.
Die Methode ist auf Materialien beschränkt, die im zu untersuchenden Temperaturbereich reagieren oder sich zersetzen, kann jedoch nicht für eine Sublimation oder VerdampfungVerdampfung beschreibt die Phasenumwandlung eines Stoffes von der flüssigen in die gasförmige Phase. Beim Verdampfen eines Stoffes unterscheidet man grundsätzlich zwei Formen, Sieden und Verdunstung.Verdampfung angewandt werden.
Hinweise zu den Messbedingungen:
Da die Ergebnisse von der Probenmasse, der Atmosphäre (Gas- und Durchflussrate), der Heizrate und dem Tiegeltyp beeinflusst werden, ist es wichtig, die Messbedingungen zu definieren. Aus dem gleichen Grund können die Ergebnisse für zwei Proben nur dann verglichen werden, wenn die Messungen unter exakt denselben Bedingungen durchgeführt werden.
Folgende Messbedingungen werden im Allgemeinen empfohlen:
- Probenmasse: zwischen 1 und 10 mg, z.B. 5 mg
- Heizrate: 10 bis 20 K/min (niedriger für energetische Reaktionen: 1 bis 10 K/min)
- Durchflussrate der Atmosphäre: 20 bis 100 ml/min
Im vorliegenden Beispiel ist die thermische Stabilität bei 102 °C für Acetysalicylsäure für eine Messung in dynamischer Stickstoffatmosphäre (Gasdurchfluss: 40 ml/min) an einer Probe von 5 mg mit einer Heizrate von 10 K/min angegeben (Abbildung 2).
Thermische Stabilität und Haltbarkeit
Analyse mittels Kinetics Neo
Eine thermogravimetrische Messung zeigt den Einfluss der Temperatur auf ein Material in einer bestimmten Atmosphäre. Hängt der beobachtete Massenverlust von der Heizrate ab, dann ist es möglich, TG-Messungen mit unterschiedlichen Heizraten für eine kinetische Analyse der Reaktion heranzuziehen. Dafür bietet NETZSCH die Software Kinetics Neo an. Sie erlaubt die Modellierung der Kinetik von ein- bis mehrstufigen Reaktionen. Diese Software erlaubt in einfacher Art und Weise, jeder einzelnen Stufe verschiedene Reaktionsarten mit eigenen kinetischen Parametern wie Aktivierungsenergie, Reaktionsordnung und Präexponentialfaktor zuzuordnen. Basierend auf den Ergebnissen ist Kinetics Neo in der Lage, die Reaktion(en) für anwenderspezifische Temperaturprogramme, z.B. für Langzeitisothermen, zu simulieren. Daher liefern die mittels Kinetics Neo berechneten Vorhersagen Informationen über die thermische Stabilität einer Substanz, d.h. die Zeit, in der sie unter bestimmten atmosphärischen und Temperaturbedingungen unverändert erhalten bleibt.
Bestimmung der thermischen Stabilität
Ein Beispiel für die Bestimmung der thermischen Stabilität eines pharmazeutischen Produkts ist in der NETZSCH Application Note 122 [2] erläutert.
Bemerkungen zur Bestimmung der Haltbarkeit eines Medikaments in Hinblick auf thermische Stabilität:
- Durchführung von TG-Messungen mit unterschied-lichen Heizraten
- Durchführung der Kinetik-Auswertung mit Kinetics Neo
- Verwendung des ermittelten Kinetikmodells zur Vorhersage des Probenverhaltens für bestimmte Temperaturen und Zeiten
- Bestätigung des kinetischen Modells durch Vergleich einer Messung bei isotherme Temperatur mit der mittels Kinetics Neo berechneten Kurve
Wichtige Hinweise:
- Auch andere Faktoren als Temperatur und Atmosphäre haben Einfluss auf die Haltbarkeit eines Produkts, z.B. Feuchtigkeit, Licht oder Verlust der Mischbarkeit bei Salben. Deshalb geben die mittels TG und Kinetics Neo durchgeführten Vorhersagen keine Auskunft über die gesamte Haltbarkeit eines Produktes, sondern nur über dessen Haltbarkeit in Hinblick auf die thermische Stabilität.
- Die Vorhersagen gelten für Substanzen, die sich bei der Temperatur der Vorhersage und bei der Temperatur zu Zersetzungsbeginn im gleichen physikalischen Zustand befinden. Ist das Material bei Raumtemperatur im festen Zustand und beginnt vor der Zersetzung zu schmelzen, ist die kinetische Analyse der Zersetzung nur für den flüssigen Zustand gültig. In diesem Fall ist eine Vorhersage mit dem berechneten Modell bei Temperaturen unterhalb des Schmelzpunkts nicht möglich.
2. Kompatibilität
Im Allgemeinen enthält eine pharmazeutische Formulierung einen pharmazeutischen Wirkstoff und mehrere Hilfsstoffe.
Der pharmazeutische Wirkstoff, auch API (Active Pharmaceutical Ingredient) genannt, ist die Substanz, die eine „unmittelbare Wirkung auf die Diagnose, Heilung, Linderung, Behandlung oder Prävention einer Krankheit“ [3] hat.
Für die verschiedenen Hilfsstoffe gibt es unterschiedliche Zielsetzungen: sie können den Herstellungsprozess vereinfachen, das Aussehen des Endprodukts (Farbe, Geschmack) verbessern und dazu beitragen, dass der API gezielt eingesetzt wird.
Die Hilfsstoffe in der Formulierung sollten die Wirksamkeit, Stabilität oder Sicherheit des Medikaments nicht beeinflussen. In anderen Worten, es sollte sichergestellt sein, dass API und Hilfsstoffe kompatibel sind.
Erste Informationen über die Kompatibilität eines Medikaments und Hilfsstoffe lassen sich mittels thermischer Analyse, insbesondere DSC und TG, erhalten.
Hinweise zur Bestimmung von Wechselwirkungen auf den API und Hilfsstoff:
- DSC- und TG-Messungen am API und separat am Hilfsstoff durchführen
- Mischen von API und Hilfsstoff (Gewicht: 50/50)
- DSC- und TG-Messung an der Mischung aus API+ Hilfsstoff starten
DSC-Kurven von API, Hilfsstoff und Mischungen
Abbildung 3 zeigt, wie die DSC-Kurven Informationen über eine mögliche Wechselwirkung zwischen den beiden Komponenten liefern. Eine resultierende DSC-Kurve, die keine Wechselwirkung zwischen API und Hilfsstoff aufweist (Abbildung 3c), zeigt an, dass der Hilfsstoff für die Formulierung mit dem API empfohlen wird. Das Auftreten eines neuen Peaks in der Mischung, das Verschwinden eines Peak oder einer Änderung des Schmelzpeaks (in Form, Lage oder Enthalpie) weist auf eine Wechselwirkung zwischen den beiden Komponenten hin (Abbildung 3d). Das bedeutet jedoch nicht zwangsläufig, dass das Medikament und der Hilfsstoff nicht kompatibel sind. Weitere Untersuchungen müssten mit anderen Techniken (Röntgen, Spektroskopie, Chromatographie usw.) durchgeführt werden, um die Unverträglichkeit zu bestätigen.
a) DSC-Kurve des API mit Schmelzpeak

b) DSC-Kurve des Hilfsstoffs mit Schmelzpeak
c) DSC-Kurve der Mischung aus API+Hilfsstoff OHNE Wechselwirkung zwischen den beiden Komponenten. Ein Schmelzpeak wird bei der gleichen Temperatur wie in den DSC-Kurven für die einzelnen Komponenten detektiert. Das bedeutet, API und Hilfsstoff sind kompatibel.
d) DSC-Kurve an der Mischung aus API+Hilfsstoff MIT Wechselwirkung zwischen den beiden Komponenten. Anstelle der beiden separaten Schmelzpeaks wird ein endothermer Peak detektiert.
Die Funktion Superposition in der Auswertesoftware von NETZSCH erlaubt die Darstellung einer Kurve, die man für eine Mischung erhalten würde, wenn keine Wechselwirkung zwischen den beiden Komponenten stattfindet. Dazu werden die Kurven der einzelnen Substanzen in die Auswertesoftware geladen und die „überlagerte“ Kurve berechnet. Dies vereinfacht einen Vergleich zwischen der gemessenen Kurve der Mischung und der mittels SuperPosition berechneten Kurve.
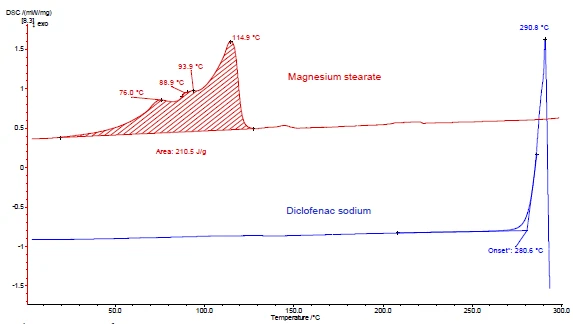
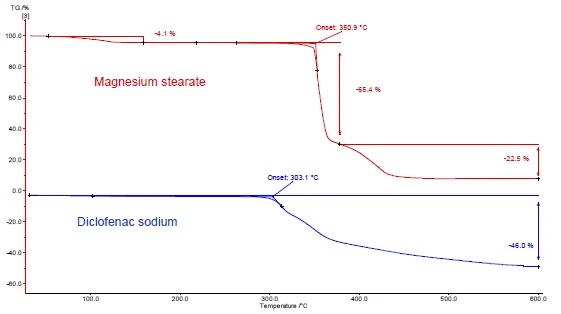
Abbildungen 4 und 5 demonstrieren anhand von DSC- und TG-Messungen am Beispiel von Diclofenac-Natrium und Magnesiumstearat wie vorzugehen ist. In den Abbildungen 4a und 5a sind die beiden Substanzen während der Aufheizung dargestellt.
Der zwischen Raumtemperatur und 130 °C in der DSC-Kurve detektierte endotherme Peak von Magnesium-
Stearat (Abbildung 4a, obere Kurve) ist teilweise auf die Verdampfung von Wasser zurückzuführen. Er entspricht in diesem Temperaturbereich einem Massenverlust in der TG-Kurve (Abbildung 5a, obere Kurve). Der Peak der Wasserverdampfung von 4,1 % ist vom Schmelzen des Magnesiumstearats überlagert [9].
Diclofenac-Natrium (Abbildung 4a, untere Kurve) zeigt einen endothermen Peak bei 291 °C, entsprechend des Schmelzens. Unmittelbar nach dem Schmelzen folgt ein exothermer Prozess, verbunden mit einem Massenverlust von 46 %, und ist auf die Zersetzung von Diclofenac zurückzuführen ist.

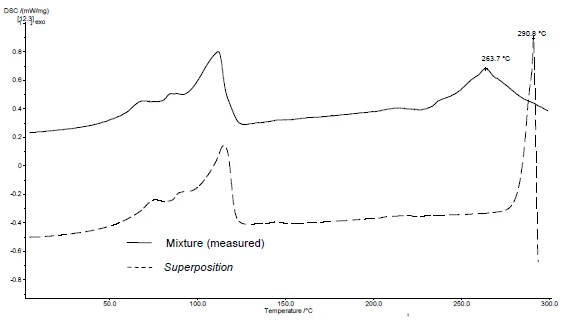

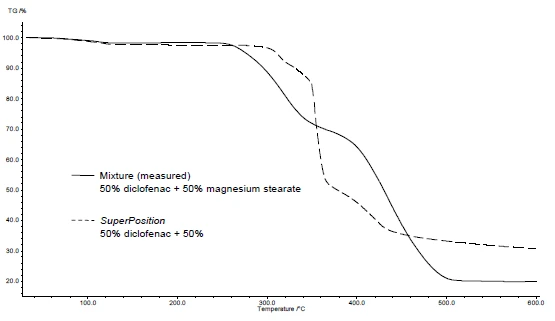
Die Anwendung von SuperPosition (Abbildungen 4b, 5b) ermöglicht einen Vergleich der gemessenen Kurve der Mischung mit der berechneten Kurve, die man ohne Wechselwirkung erhalten würde. Bleiben die Effekte der einzelnen Substanzen unverändert, d.h. ohne weitere Unterschiede erhalten, weist dies auf eine kompatible Mischung hin.
In diesem Beispiel setzt die Zersetzung der Mischung bei 278 °C ein, d.h. bei einer niedrigeren Temperatur als für das Hilfsmittel allein (Abbildung 5c). Der für Diclofenac typische Schmelzpeak wird in der Mischung nicht mehr detektiert. Stattdessen tritt ein breiter endothermer Peak bei 264 °C auf (Abbildung 4c).
Die Tatsache, dass in dem Beispiel Unterschiede detektiert wurden, deutet auf eine Wechselwirkung zwischen Diclofenac-Natrium und Magnesium-Stearat hin (Abbildungen 4c und 5c).
Ein weiteres Beispiel für eine Verträglichkeitsstudie an Diclofenac-Natrium mit unterschiedlichen Hilfsstoffen mittels DSC und TG ist in der NETZSCH Application Note 120 [4] zu finden.
3. Polymorphie
Polymorphie ist die Fähigkeit eines Materials, in mehr als einer Kristallform zu existieren. Die unterschiedlichen polymorphen Formen eines Arzneimittels werden in der Regel als α, β, … oder I, II, ... oder A, B, ..., bezeichnet, wobei die Modifikation α/I/A die stabilste ist.
Für der Pharmaindustrie stellt die Polymorphie eine große Herausforderung dar, denn obwohl zwei polymorphe Substanzen die gleiche chemische Zusammensetzung haben können, unterscheiden sie sich in ihren Eigenschaften. Da sich die Struktur einer polymorphen Substanz mit der Zeit ändern kann, können während der Lagerung unerwartete Änderungen bezüglich Bioverfügbarkeit, physikalische Eigenschaften, Stabilität usw. auftreten. Aus diesem Grund ist es neben der Patentanmeldung von entscheidender Bedeutung, sich über das Vorkommen aller potentieller Modifikationen einer polymorphen Substanz sowie der Eigenschaften, z.B. Stabilität und der Qualität jeder einzelnen Substanz bewusst zu sein und diese zu kennen.
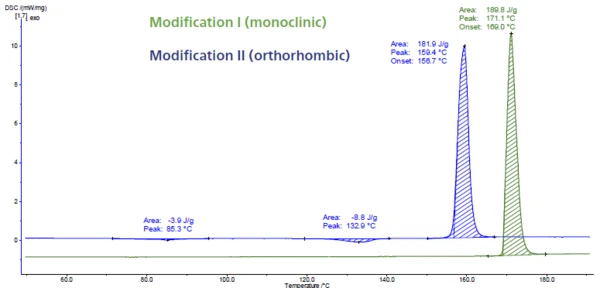
Paracetamol
In Abbildung 6 ist die DSC-Messung an Paracetamol dargestellt. Dieser API (Active Pharmaceutical Ingredient) hat drei verschiedene Modifikationen, I, II und III genannt. Die Modifikation III ist instabil und daher schwer zu charakterisieren. Die Modifikationen I und II unterschieden sich sowohl in ihrer thermodynamischen Stabilität als auch ihrer Kompressionsfähigkeit. In diesem Fall ist eine Identifizierung mittels DSC einfach, da diese beiden Modifikationen eine unterschiedliche Schmelztemperaturen und SchmelzenthalpienDie Schmelzenthalpie einer Substanz, auch bekannt als latente Wärme, stellt ein Maß der Energiezufuhr dar, typischerweise Wärme, welche notwendig ist, um eine Substanz vom festen in den flüssigen Zustand zu überführen. Der Schmelzpunkt einer Substanz ist die Temperatur, bei der die Substanz von einem festen (kristallinen) in den flüssigen Zustand (isotrope Schmelze) übergeht.Schmelztemperatur besitzen. Der Schmelzpeak bei 169 °C (extrapolierte Onsettemperatur, grüne Kurve) ist typisch für die monokline Form. Es ist die Modifikation mit dem höchsten Schmelzpunkt und zugleich die stabilste. Der Peak bei 157 °C (extrapolierte Onsettemperatur, blaue Kurve) besitzt eine orthorhombische Kristallstruktur. Diese weist bessere Kompressionseigenschaften auf [5, 6].
Obwohl die Form II ohne Zusatz von Hilfsstoffen direkt komprimiert werden könnte, wird das handelsübliche Paracetamol aufgrund seiner besseren Stabilität aus der monoklinischen Form (Form I ) hergestellt [7, 8].
4. Pseudopolymorphie
Zwei pseudopolymorphe Modifikationen weisen unterschiedliche Kristallformen aufgrund von Hydratation oder Solvatation auf.
In einem Solvat sind die Lösungsmittelmoleküle in der Kristallstruktur der Substanz eingeschlossen. Enthält diese mehr als zwei Lösungsmittel, spricht man von einem Hetero-Solvat. In einem Hydrat ist das Lösungsmittel in Verbindung mit der Substanz Wasser.
Die Charakterisierung von Solvaten und Hydraten erfolgt mittels Thermogravimetrie, wenn möglich, gekoppelt mit Emissionsgasanalyse. Mit einer TG-Messung erhält man Informationen über die in der Probe vorhandene Menge an Lösungsmittel/Wasser und somit über den Grad der Solvatation/Hydratation. Die Kopplung erlaubt die Identifizierung der während der Aufheizung freigesetzten Lösungsmittel.
Zusammenfassung
Mit der thermischen Analyse – insbesondere der DSC- and TG-Methode – können unterschiedliche Eigenschaften von Wirk- und Zusatzstoffen untersucht werden. Dies wiederum erlaubt die Bestimmung der thermischen Stabilität, Kompatibilität sowie der Polymorphie und Pseudopolymorphie von Pharmazeutika.