Introduzione
Di seguito vengono spiegati alcuni termini specifici del settore farmaceutico:
- Stabilità termicaUn materiale è termicamente stabile se non si decompone sotto l'influenza della temperatura. Un modo per determinare la stabilità termica di una sostanza è quello di utilizzare un TGA (analizzatore termogravimetrico). Stabilità termica
- Compatibilità
- PolimorfismoIl polimorfismo è la capacità di un materiale solido di formare diverse strutture cristalline (sinonimi: forme, modificazioni).Polimorfismo
- Pseudo-PolimorfismoIl polimorfismo è la capacità di un materiale solido di formare diverse strutture cristalline (sinonimi: forme, modificazioni).polimorfismo
1. Stabilità termica
La norma ASTM E2550 descrive la Stabilità termicaUn materiale è termicamente stabile se non si decompone sotto l'influenza della temperatura. Un modo per determinare la stabilità termica di una sostanza è quello di utilizzare un TGA (analizzatore termogravimetrico). stabilità termica di un materiale come "la temperatura alla quale il materiale inizia a decomporsi o a reagire e l'entità della variazione di massa utilizzando la termogravimetria". Aggiunge che "l'assenza di reazione o Reazione di decomposizioneUna reazione di decomposizione è una reazione termicamente indotta di un composto chimico che forma prodotti solidi e/o gassosi. decomposizione è usata come indicazione della Stabilità termicaUn materiale è termicamente stabile se non si decompone sotto l'influenza della temperatura. Un modo per determinare la stabilità termica di una sostanza è quello di utilizzare un TGA (analizzatore termogravimetrico). stabilità termica".
La Figura 1 mostra la curva TGA dell'acido acetilsalicilico durante il riscaldamento a 600°C in atmosfera di azoto.
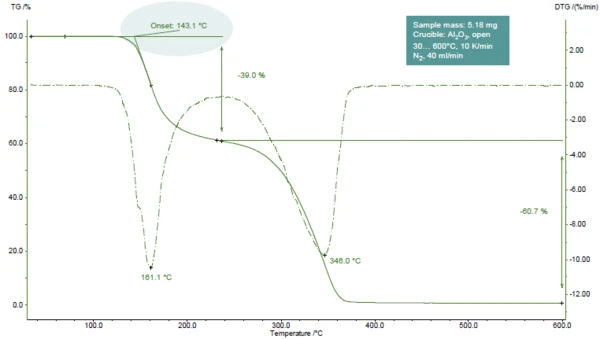
Sono state rilevate due fasi di perdita di massa, facilmente riconoscibili dai due picchi nella curva DTG (prima derivata della curva TGA). Le indagini TGA-FT-IR hanno mostrato che durante la prima fase si sviluppano acido acetico (parte principale) e acido salicilico. Durante la seconda fase, vengono rilasciati acido salicilico eCO2 (risultante dall'ulteriore Reazione di decomposizioneUna reazione di decomposizione è una reazione termicamente indotta di un composto chimico che forma prodotti solidi e/o gassosi. decomposizione dell'acido acetilsalicilico) [1].
Ciascuna di queste fasi di perdita di massa è determinata da:
- la temperatura
- la variazione di massa
Teoricamente, per una fase di perdita di massa possono essere visualizzate tre temperature:
- Temperatura di picco del DTG (1a derivata della curva TGA)
- Temperatura di insorgenza estrapolata secondo la norma ISO 11358-1. Si tratta del "punto di intersezione della linea di base all'inizio della misurazione e della tangente alla curva TGA nel punto di massima pendenza"
Temperatura di inizio secondo ASTM E2550. È il "punto della curva TGA in cui si osserva per la prima volta una deviazione dalla linea di base stabilita prima dell'evento termico"
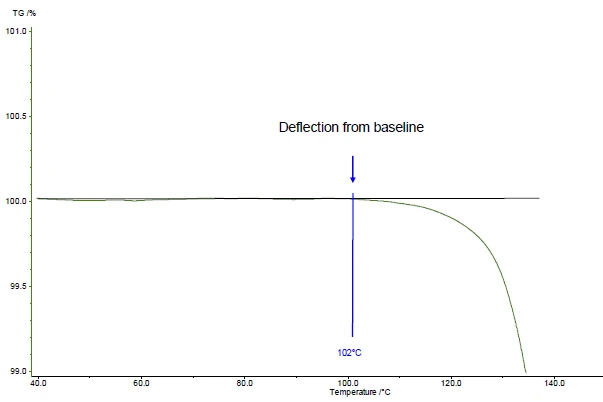
Nell'esempio presentato, la prima fase di perdita di massa si verifica a 161°C (picco della curva DTG, figura 1), a 143°C (temperatura di inizio estrapolata della curva TGA, figura 1) o a 102°C (temperatura di inizio secondo ASTM E2550, figura 2). Questo terzo valore viene utilizzato per valutare la Stabilità termicaUn materiale è termicamente stabile se non si decompone sotto l'influenza della temperatura. Un modo per determinare la stabilità termica di una sostanza è quello di utilizzare un TGA (analizzatore termogravimetrico). stabilità termica.
Il metodo è limitato ai materiali che reagiscono o si decompongono nell'intervallo di temperatura indagato e non può essere utilizzato per la sublimazione o la VaporizzazioneLa vaporizzazione di un elemento o di un composto è una transizione di fase dalla fase liquida al vapore. Esistono due tipi di vaporizzazione: l'evaporazione e l'ebollizione.vaporizzazione.
Note relative alle condizioni di misurazione:
Poiché i risultati sono influenzati dalla massa del campione, dall'atmosfera (gas e portata), dalla velocità di riscaldamento e dal tipo di crogiolo, è fondamentale menzionare le condizioni di misurazione. Per lo stesso motivo, i risultati di due campioni possono essere confrontati solo se le misure vengono effettuate esattamente nelle stesse condizioni.
In generale, si raccomandano le seguenti condizioni di misurazione:
- Massa del campione: tra 1 e 10 mg, ad esempio 5 mg
- Velocità di riscaldamento: da 10 a 20 K/min (più bassa per le reazioni energetiche: da 1 a 10 K/min)
- Portata dell'atmosfera: da 20 a 100 ml/min
Nell'esempio presentato, la Stabilità termicaUn materiale è termicamente stabile se non si decompone sotto l'influenza della temperatura. Un modo per determinare la stabilità termica di una sostanza è quello di utilizzare un TGA (analizzatore termogravimetrico). stabilità termica a 102°C dell'acido acetilsalicilico è indicata per una misurazione in atmosfera dinamica di azoto (flusso di gas: 40 ml/min) effettuata su un campione di 5 mg a una velocità di riscaldamento di 10 K/min (figura 2).
Analisi cinetica Neo
Una misura termogravimetrica mostra l'effetto della temperatura su un materiale in un'atmosfera specifica. Se la perdita di massa osservata dipende dalla velocità di riscaldamento, è possibile utilizzare le misure TGA a diverse velocità di riscaldamento per effettuare un'analisi cinetica della reazione. A questo scopo, NETZSCH offre il software Kinetics Neo. Esso consente di modellare la cinetica di reazioni da uno a più stadi. Questo software è in grado di assegnare ogni singola fase a diversi tipi di reazione con parametri cinetici propri, come l'energia di attivazione, l'ordine di reazione e il fattore pre-esponenziale. Sulla base dei risultati, Kinetics Neo è in grado di simulare le reazioni per programmi di temperatura specificati dall'utente, ad esempio per isoterme di lunga durata. Per questo motivo, le previsioni calcolate con Kinetics Neo forniscono informazioni sulla durata di conservazione per quanto riguarda la Stabilità termicaUn materiale è termicamente stabile se non si decompone sotto l'influenza della temperatura. Un modo per determinare la stabilità termica di una sostanza è quello di utilizzare un TGA (analizzatore termogravimetrico). stabilità termica di un materiale, ossia la quantità di tempo in cui rimane stabile in un'atmosfera e in condizioni di temperatura specifiche.
Un esempio di determinazione della durata di conservazione in relazione alla Stabilità termicaUn materiale è termicamente stabile se non si decompone sotto l'influenza della temperatura. Un modo per determinare la stabilità termica di una sostanza è quello di utilizzare un TGA (analizzatore termogravimetrico). stabilità termica di un prodotto farmaceutico è illustrato nella nota applicativa 122 di NETZSCH [2].
Note relative alla determinazione della durata di conservazione di un farmaco in relazione alla Stabilità termicaUn materiale è termicamente stabile se non si decompone sotto l'influenza della temperatura. Un modo per determinare la stabilità termica di una sostanza è quello di utilizzare un TGA (analizzatore termogravimetrico). stabilità termica:
- Eseguire le misurazioni TGA a diverse velocità di riscaldamento
- Eseguire la valutazione della cinetica con Kinetics Neo
- Utilizzare il modello cinetico determinato per prevedere il comportamento del campione per temperature e tempi specifici
- Convalidare il modello cinetico confrontando una misurazione a una temperatura isoterma con la curva calcolata da Kinetics Neo.
Osservazioni importanti:
- Anche fattori diversi dalla temperatura e dall'atmosfera influenzano la durata di conservazione di un prodotto, ad esempio l'umidità, la luce o la perdita di miscibilità nel caso degli unguenti. Per questo motivo, le previsioni effettuate con TGA e Kinetics Neo non forniscono informazioni sulla durata di conservazione completa di un prodotto, ma solo sulla sua durata di conservazione in relazione alla Stabilità termicaUn materiale è termicamente stabile se non si decompone sotto l'influenza della temperatura. Un modo per determinare la stabilità termica di una sostanza è quello di utilizzare un TGA (analizzatore termogravimetrico). stabilità termica.
- Le previsioni sono valide per le sostanze che si trovano nello stesso stato fisico alla temperatura di previsione e alla temperatura di inizio Reazione di decomposizioneUna reazione di decomposizione è una reazione termicamente indotta di un composto chimico che forma prodotti solidi e/o gassosi. decomposizione. Se un materiale è allo stato solido a temperatura ambiente e si scioglie prima di iniziare a decomporsi, l'analisi cinetica della Reazione di decomposizioneUna reazione di decomposizione è una reazione termicamente indotta di un composto chimico che forma prodotti solidi e/o gassosi. decomposizione è valida solo per lo stato liquido. In tal caso, non è possibile effettuare alcuna previsione utilizzando il modello calcolato a temperature inferiori al Temperature di fusione ed entalpieL'entalpia di fusione di una sostanza, nota anche come calore latente, è una misura dell'apporto di energia, tipicamente calore, necessario per convertire una sostanza dallo stato solido a quello liquido. Il punto di fusione di una sostanza è la temperatura alla quale essa cambia stato da solido (cristallino) a liquido (fusione isotropa).punto di fusione.
2. Compatibilità
In generale, una formulazione farmaceutica contiene un ingrediente farmaceutico attivo e diversi eccipienti.
L'ingrediente farmaceutico attivo, chiamato anche API (Active Pharmaceutical Ingredient), è la sostanza che ha un "effetto diretto sulla diagnosi, la cura, l'attenuazione, il trattamento o la prevenzione delle malattie" [3].
I vari eccipienti hanno obiettivi diversi: possono facilitare il processo di produzione, migliorare l'aspetto del prodotto finale (colore, sapore) e aiutare l'API a essere somministrato correttamente.
La presenza degli eccipienti nella formulazione non deve influire sull'efficacia, sulla stabilità o sulla sicurezza del farmaco. In altre parole, si deve garantire che l'API e gli eccipienti siano compatibili.
Le prime informazioni sulla compatibilità di un farmaco e di un eccipiente possono essere ottenute con l'analisi termica, in particolare con DSC e TGA.
Note sulla determinazione delle interazioni tra API ed eccipiente:
- Eseguire misure DSC e TGA sull'API e, separatamente, sull'eccipiente
- Miscelare l'API e l'eccipiente (peso 50/50)
- Eseguire misure DSC e TGA sulla miscela di API ed eccipiente
Curve DSC di API, eccipienti e miscele
La figura 3 mostra come le curve DSC forniscano informazioni su una potenziale interazione tra due componenti. Una curva DSC che non mostra alcuna interazione tra API ed eccipiente (figura 3c) indica che l'eccipiente è raccomandato per la formulazione con l'API. La comparsa di un nuovo picco nella miscela, la scomparsa di un picco o un cambiamento nel picco diTemperature di fusione ed entalpieL'entalpia di fusione di una sostanza, nota anche come calore latente, è una misura dell'apporto di energia, tipicamente calore, necessario per convertire una sostanza dallo stato solido a quello liquido. Il punto di fusione di una sostanza è la temperatura alla quale essa cambia stato da solido (cristallino) a liquido (fusione isotropa). fusione (nella forma, nella posizione o nell'entalpia) indicherebbe che c'è un'interazione tra i due componenti (figura 3d). Tuttavia, questo non significa necessariamente che il farmaco e l'eccipiente non siano compatibili. Per confermare l'incompatibilità, è necessario effettuare ulteriori indagini con altre tecniche (raggi X, spettroscopia, cromatografia, ecc.).
c) Curva DSC della miscela API+eccipiente SENZA interazione tra i due componenti. Si rileva un picco diTemperature di fusione ed entalpieL'entalpia di fusione di una sostanza, nota anche come calore latente, è una misura dell'apporto di energia, tipicamente calore, necessario per convertire una sostanza dallo stato solido a quello liquido. Il punto di fusione di una sostanza è la temperatura alla quale essa cambia stato da solido (cristallino) a liquido (fusione isotropa). fusione alla stessa temperatura delle curve DSC dei singoli componenti. Ciò significa che API ed eccipiente sono compatibili.
c) Curva DSC della miscela API+eccipiente SENZA interazione tra i due componenti. Si rileva un picco diTemperature di fusione ed entalpieL'entalpia di fusione di una sostanza, nota anche come calore latente, è una misura dell'apporto di energia, tipicamente calore, necessario per convertire una sostanza dallo stato solido a quello liquido. Il punto di fusione di una sostanza è la temperatura alla quale essa cambia stato da solido (cristallino) a liquido (fusione isotropa). fusione alla stessa temperatura delle curve DSC dei singoli componenti. Ciò significa che API ed eccipiente sono compatibili.
La funzione Superposition del software di valutazione NETZSCH consente di rappresentare la curva che si otterrebbe per una miscela in assenza di interazione tra i due componenti. A tal fine, le curve delle singole sostanze vengono caricate nel software di valutazione e viene calcolata la curva "sovrapposta". È quindi molto facile fare un confronto tra la curva misurata della miscela e la curva calcolata mediante la Superposizione.
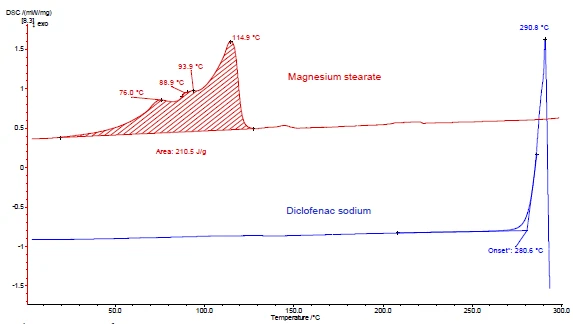
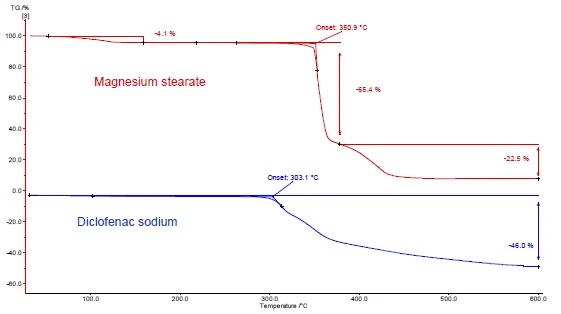
Le figure 4 e 5 mostrano come procedere con l'esempio del diclofenac sodico e dello stearato di magnesio. Sono state effettuate misure DSC e TGA. Le figure 4a e 5a mostrano le curve DSC e TGA, rispettivamente, delle due sostanze durante il riscaldamento.
Il picco EndotermicoUna transizione campionaria o una reazione è endotermica se per la conversione è necessario il calore.endotermico tra la temperatura ambiente e i 130°C rilevato nella curva DSC dello stearato di magnesio (figura 4a, curva rossa, in alto) è dovuto in parte all'evaporazione dell'acqua. Corrisponde a una perdita di massa nella curva TGA (4,1%) per questo intervallo di temperatura. Il picco di rilascio dell'acqua si sovrappone alla fusione dello stearato di magnesio [9].
Il diclofenac sodico (figura 4a, curva blu, sotto) mostra un picco EndotermicoUna transizione campionaria o una reazione è endotermica se per la conversione è necessario il calore.endotermico a 291°C, corrispondente alla sua fusione. Un processo EsotermicoUna transizione campionaria o una reazione è esotermica se viene generato calore.esotermico immediatamente successivo alla fusione è associato a una perdita di massa del 46% e deriva dalla Reazione di decomposizioneUna reazione di decomposizione è una reazione termicamente indotta di un composto chimico che forma prodotti solidi e/o gassosi. decomposizione del diclofenac.

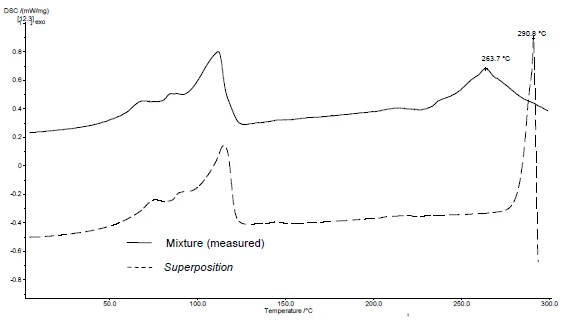

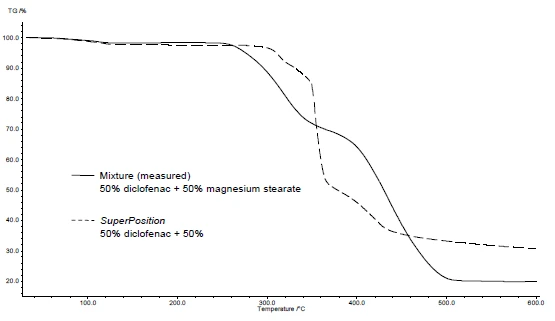
L'applicazione di SuperPosition (figure 4b, 5b) consente di confrontare la curva misurata della miscela con la curva calcolata che si otterrebbe in assenza di interazione. Nessuna differenza tra le due curve indicherebbe una miscela compatibile.
In questo esempio, la Reazione di decomposizioneUna reazione di decomposizione è una reazione termicamente indotta di un composto chimico che forma prodotti solidi e/o gassosi. decomposizione della miscela inizia a 278°C, cioè a una temperatura inferiore a quella del solo eccipiente (figura 5c). Il picco di fusione tipico del diclofenac non è più presente nella miscela. Viene invece rilevato un ampio picco EndotermicoUna transizione campionaria o una reazione è endotermica se per la conversione è necessario il calore.endotermico a 264°C (figura 4c).
Il fatto che siano state rilevate differenze nell'esempio indica che esiste un'interazione tra diclofenac sodico e magnesio stearato (figure 4c e 5c).
Un ulteriore esempio di studio di compatibilità del diclofenac sodico con diversi eccipienti mediante DSC e TGA è riportato nella nota applicativa 120 di NETZSCH [4].
3. Polimorfismo
Il PolimorfismoIl polimorfismo è la capacità di un materiale solido di formare diverse strutture cristalline (sinonimi: forme, modificazioni).polimorfismo è la capacità di un materiale di esistere in più di una forma cristallina. Le diverse forme polimorfiche di una sostanza farmaceutica sono solitamente chiamate α, β, ... o I, II, ... o A, B, ..., dove la modifica α/I/A è quella più stabile.
Nell'industria farmaceutica, il PolimorfismoIl polimorfismo è la capacità di un materiale solido di formare diverse strutture cristalline (sinonimi: forme, modificazioni).polimorfismo è molto impegnativo perché, anche se due sostanze polimorfiche hanno la stessa composizione chimica, differiscono nelle loro proprietà. Poiché una sostanza polimorfa può cambiare la sua struttura nel tempo, durante la conservazione possono verificarsi cambiamenti inaspettati nella biodisponibilità, nelle proprietà fisiche, nella stabilità, ecc. Per questo motivo, oltre che per la registrazione del brevetto, è fondamentale essere consapevoli e conoscere l'esistenza di tutte le potenziali modifiche di una sostanza polimorfa e le proprietà, la stabilità e la qualità di ciascuna di esse.
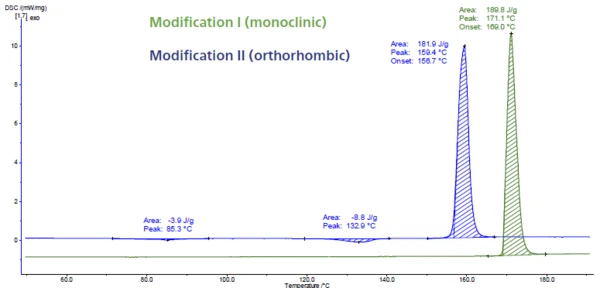
La Figura 6 mostra la misurazione DSC del paracetamolo. Questo API (Active Pharmaceutical Ingredient) presenta tre modificazioni denominate I, II e III. La modifica III è instabile e quindi difficile da caratterizzare. Le modifiche I e II differiscono per la loro stabilità termodinamica e per la loro capacità di compressione. Possono essere facilmente identificate mediante DSC perché laTemperature di fusione ed entalpieL'entalpia di fusione di una sostanza, nota anche come calore latente, è una misura dell'apporto di energia, tipicamente calore, necessario per convertire una sostanza dallo stato solido a quello liquido. Il punto di fusione di una sostanza è la temperatura alla quale essa cambia stato da solido (cristallino) a liquido (fusione isotropa). temperatura di fusione viene rilevata a temperature diverse. Il picco di fusione a 169°C (temperatura di insorgenza estrapolata, curva verde) è tipico della forma monoclina. È la modifica con il Temperature di fusione ed entalpieL'entalpia di fusione di una sostanza, nota anche come calore latente, è una misura dell'apporto di energia, tipicamente calore, necessario per convertire una sostanza dallo stato solido a quello liquido. Il punto di fusione di una sostanza è la temperatura alla quale essa cambia stato da solido (cristallino) a liquido (fusione isotropa).punto di fusione più alto e anche la più stabile. Il picco a 157°C (temperatura di insorgenza estrapolata, curva blu) appartiene alla forma ortorombica che presenta migliori proprietà di compressione [5, 6].
Sebbene la forma II possa essere compressa direttamente senza l'aggiunta di un eccipiente per migliorare la comprimibilità, il paracetamolo commerciale viene prodotto a partire dalla forma monoclina (forma I) a causa della sua migliore stabilità [7, 8].
Altri esempi di caratterizzazione di diverse modificazioni di una sostanza polimorfa sono riportati nella nota applicativa 127 di NETZSCH [10].
4. Pseudo-polimorfismo
Due modificazioni pseudopolimorfiche presentano forme cristalline diverse, dovute all'idratazione o alla solvatazione.
In un solvato, le molecole del solvente sono intrappolate nella struttura cristallina della sostanza. Se contiene più di due solventi, si parla di etero-solvato.
In un idrato, il solvente in associazione con il farmaco è l'acqua.
La caratterizzazione di solvati e idrati viene effettuata con la termogravimetria, eventualmente accoppiata all'analisi dei gas evoluti. Una misurazione TGA fornisce informazioni sulla quantità di solvente/acqua presente in un campione e quindi sul grado di solvatazione/idratazione. L'accoppiamento consente di identificare i solventi rilasciati durante il riscaldamento.
Conclusione
Mediante l'analisi termica, in particolare DSC e TGA, è possibile studiare le diverse proprietà di API ed eccipienti. Questo, a sua volta, consente di determinare la Stabilità termicaUn materiale è termicamente stabile se non si decompone sotto l'influenza della temperatura. Un modo per determinare la stabilità termica di una sostanza è quello di utilizzare un TGA (analizzatore termogravimetrico). stabilità termica, la compatibilità e il PolimorfismoIl polimorfismo è la capacità di un materiale solido di formare diverse strutture cristalline (sinonimi: forme, modificazioni).polimorfismo e pseudo-PolimorfismoIl polimorfismo è la capacità di un materiale solido di formare diverse strutture cristalline (sinonimi: forme, modificazioni).polimorfismo dei farmaci.