Giriş
Oksalatlar, oksalik asit C2H2O4 (COOH)2 (etanikarboksilik asit) tuzlarıdır. Oksalik asidin kalsiyum tuzu olan kalsiyum oksalat, susuz formda ve formül başına bir molekül su içeren bir solvat olarak, kalsiyum oksalat monohidrat CaC2O4*H2Oşeklinde kristalleşir.
Oluşum ve Uygulama
Kalsiyum oksalat monohidrat organik bir aikidin tuzu olmasına rağmen, doğada birincil mineral olarak bulunabilir. Şekil 1, Almanya'nın Erzgebirge Sıradağları'ndaki Schlema lokalitesinden bir Whewellite kristalini göstermektedir. Whewellite'ın yanı sıra weddellite de ikinci bir mineral türü olarak bilinmektedir [1].

Kalsiyum oksalat aynı zamanda böbrek taşlarının da ana bileşenidir.
Termal analizde, termobalansların işlevselliğini kontrol etmek için kalsiyum oksalat monohidrat kullanılır. Bu madde iyi bir depolama stabilitesine sahiptir; zamanla değişime uğramaz ve laboratuvar atmosferindeki nemi adsorbe etme eğilimi göstermez. Bu özellikler onu bir termobalansın sıcaklık bazlı işlevselliğini kontrol etmek için ideal bir referans madde haline getirir.
Ölçüm Koşulları
- Enstrüman
- TG 209 F1 Libra®
- Örnek
- CaC2O4*H2O
- Örnek ağırlıklar
- 8.43 mg (şekil 2'deki siyah eğri) ve
- 8.67 mg (şekil 2'deki kırmızı eğri)
- Pota
- Al2O3
- Atmosfer
- Azot
- Gaz akış hızı
- 40 ml/dak
- Isıtma oranı
- 10 K/dak (şekil 2'deki siyah eğri) ve
- 200 K/dak (şekil 2'deki kırmızı eğri)
Termogravimetri
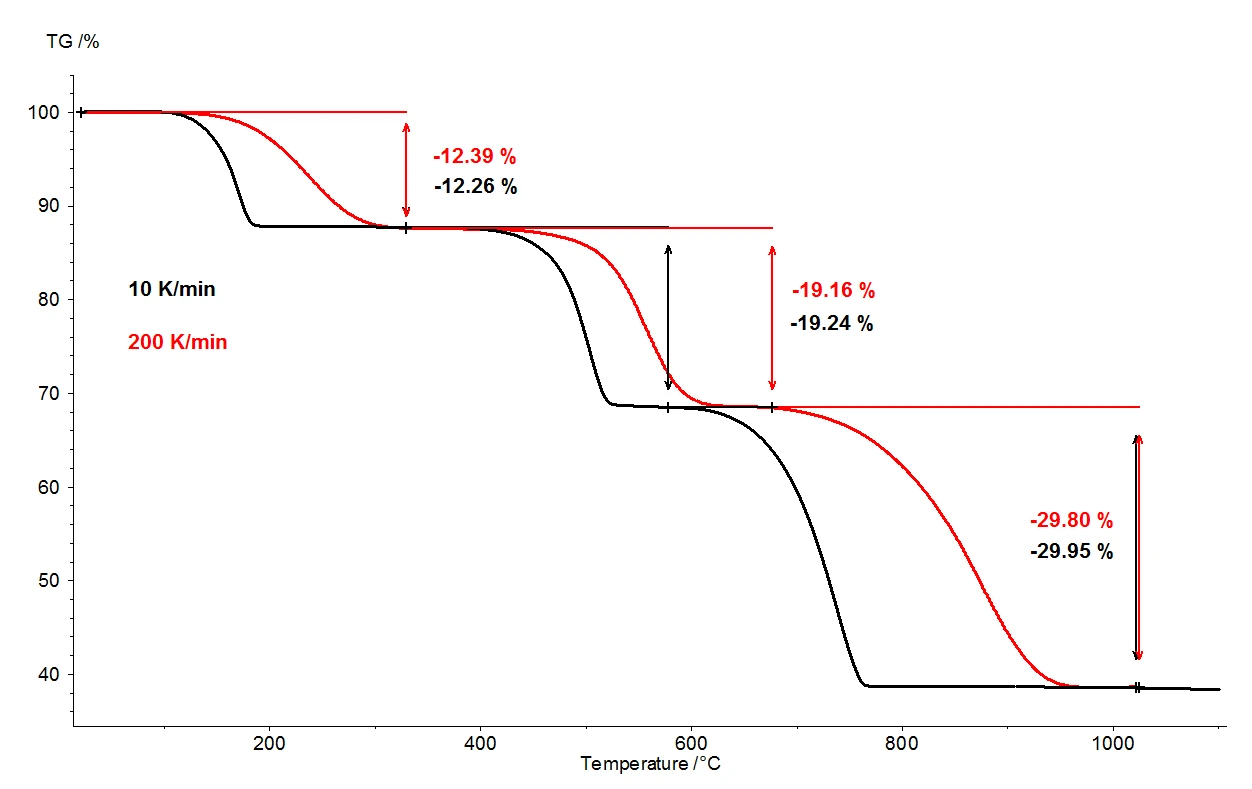
Kalsiyum oksalat monohidrat 1100°C'ye ısıtıldığında, termobalans aracılığıyla birbirinden net bir şekilde ayrılmış üç kütle kaybı adımı tespit edilebilir. Şekil 2, kalsiyum oksalat monohidrat numuneleri üzerinde yapılan iki ölçümün termogravimetrik sonuçlarının bir karşılaştırmasını göstermektedir. Numunelerin bağıl kütle değişimleri sıcaklık üzerinden kaydedilmiştir. Şekil 3'te termogravimetrik sonuçların birinci türevi (DTG) için sıcaklığın bir fonksiyonu olarak iki ölçümün benzer karşılaştırması sunulmaktadır.
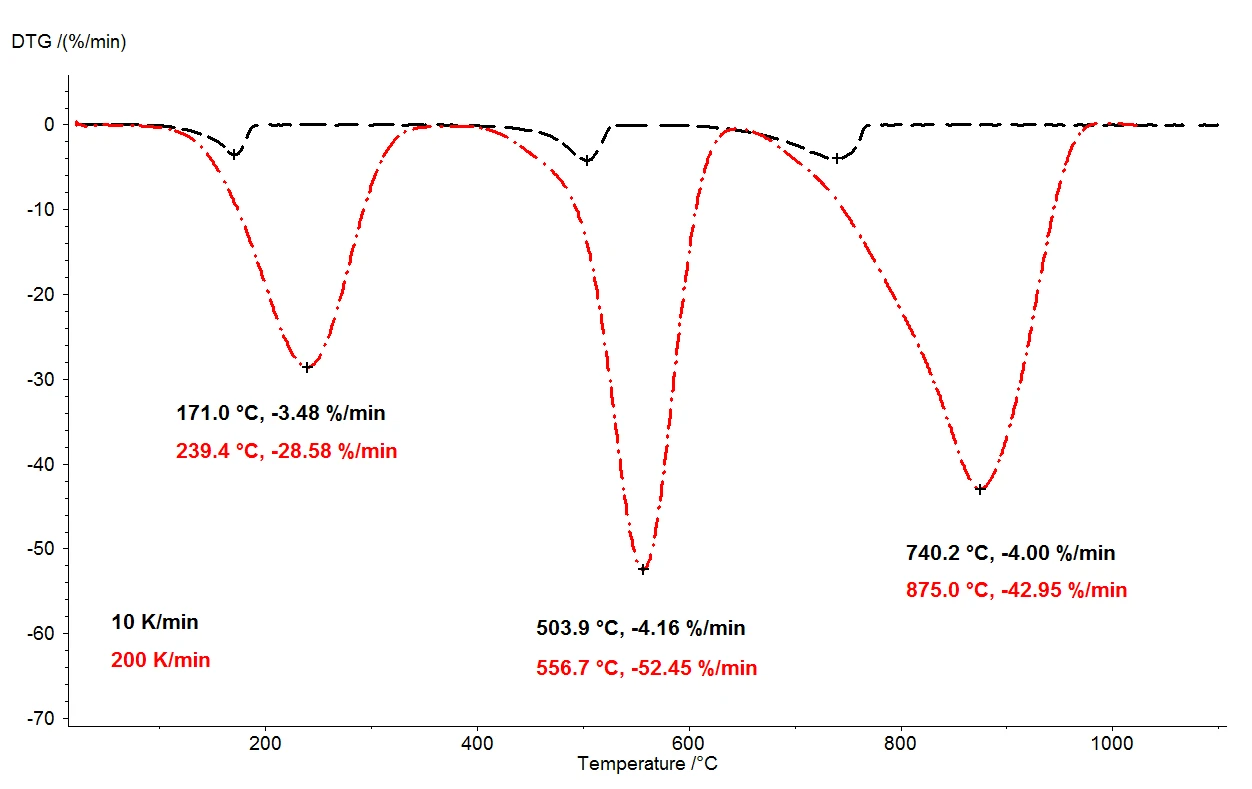
Aksi halde aynı koşullar altında, iki farklı ısıtma hızı selected: 10 K/dak (siyah eğri) ve 200 K/dak (kırmızı eğri). Isıtma hızının artmasıyla kütle kaybı adımlarının sıcaklıkları daha yüksek değerlere kaymış ve salım hızları - gaz salımının hızı - yaklaşık on kat artmıştır (DTG minimumu, şekil 3). Isıtma hızının değişmesiyle meydana gelen sıcaklık kayması, kinetik verilerin daha fazla değerlendirilmesine yönelik olarak uygulanabilecek iyi anlaşılmış bir olaydır [2]. Sıcaklık kaymasının yanı sıra, kütle kaybı adımlarının niceliğinin ısıtma hızından bağımsız olduğuna dikkat etmek de önemlidir. Bu nedenle 200 K/dak ısıtma hızı, kalsiyum oksalat monohidratın termal bozunması ile ilgili olarak daha yaygın olan 10 K/dak ısıtma hızıyla aynı bilgileri sağlar; ısıtma hızının artırılmasıyla hiçbir bilgi kaybolmaz. Bununla birlikte, aynı bilgi içeriğini sağlarken, daha hızlı ısıtma hızı muazzam zaman tasarrufu sağlar: 10 K / dk'da bir ölçüm, oda sıcaklığından 1100 ° C'ye kadar olan sıcaklık aralığını kapsamak için neredeyse iki saat sürer, ancak 200 K / dk'da aynı ölçüm zaten beş dakika içinde tamamlanır.
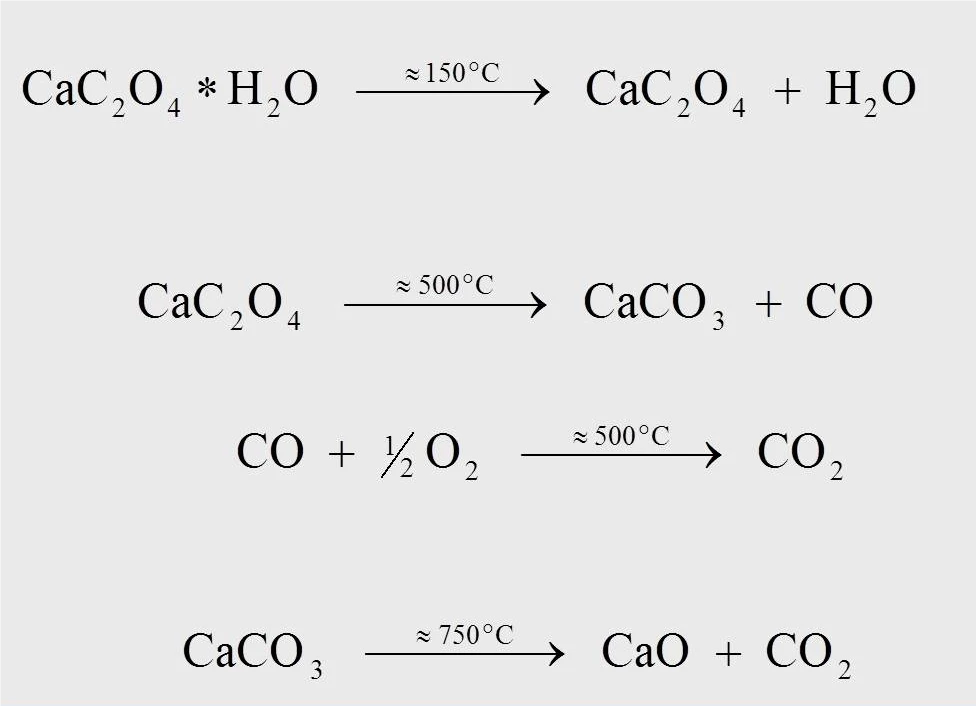
Kalsiyum oksalat monohidratın termal bozunma reaksiyonu için reaksiyon denklemleri şekil 4'te gösterilmiştir. Yaklaşık 170°C'de, 10 K/dak'da yapılan ölçümde, su monohidrattan (1) ayrıldığında susuz kalsiyum oksalat oluşur. Yaklaşık 500°C'de kalsiyum oksalat kalsiyum karbonata (CaCO3) dönüşür ve karbon monoksit (CO) ayrılır (2). Serbest kalan karbon monoksitin karbon dioksite (CO2) (3) oksitlendiği sonraki reaksiyon, yalnızca oksijen içeren bir boşaltma gazı akışında (örneğin, sentetik hava veya oksijen) gerçekleşebilir. 750°C sıcaklıkta, kalsiyum karbonatCO2 salınımı ile kalsiyum okside ayrışır (4).