Introduzione
La purezza dei prodotti farmaceutici e alimentari va di pari passo con la loro qualità. Le sostanze consegnate non devono contenere contaminanti che potrebbero essere dannosi per un organismo. Soprattutto nelle formulazioni, i contaminanti non devono interferire con l'ingrediente attivo e quindi ostacolarne il corretto funzionamento. Per questi motivi, purity determination è essenziale per le sostanze farmacologiche, cosmetiche e alimentari.
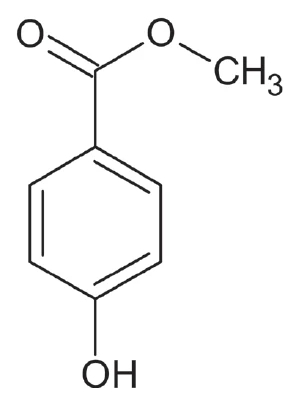
Nel presente esempio è stata determinata la purezza del Nipagin. Questa polvere bianca è nota con il nome chimico di metilparabene (figura 1) ed è utilizzata come conservante in cosmetici, farmaci e alimenti con il nome di E218 [1, 2].
La norma ASTM E928-08 descrive la procedura per purity determination mediante misure DSC. Tiene conto del fatto che "l'intervallo diTemperature di fusione ed entalpieL'entalpia di fusione di una sostanza, nota anche come calore latente, è una misura dell'apporto di energia, tipicamente calore, necessario per convertire una sostanza dallo stato solido a quello liquido. Il punto di fusione di una sostanza è la temperatura alla quale essa cambia stato da solido (cristallino) a liquido (fusione isotropa). temperatura di fusione di un composto si amplia all'aumentare del livello di impurità" [3]. Questo metodo è applicabile alle miscele con impurezze che si dissolvono nellaTemperature di fusione ed entalpieL'entalpia di fusione di una sostanza, nota anche come calore latente, è una misura dell'apporto di energia, tipicamente calore, necessario per convertire una sostanza dallo stato solido a quello liquido. Il punto di fusione di una sostanza è la temperatura alla quale essa cambia stato da solido (cristallino) a liquido (fusione isotropa). fusione e sono insolubili nel cristallo, quindi alle cosiddette impurezze eutettiche.
Condizioni di prova
L'importanza della resistenza termica - Soluzione software per risparmiare tempo di NETZSCH
Le variazioni di temperatura durante una misura DSC sono solitamente misurate sul lato di riferimento. La "vera" temperatura del campione dipende dalla resistenza termica tra il crogiolo di riferimento e quello del campione, nonché dall'entalpia dei processi che avvengono nel campione. Poiché la conoscenza della corretta temperatura del campione gioca un ruolo importante nella determinazione della purezza, la resistenza termica deve essere calcolata prima delle prove.libralibraNel software NETZSCH Proteus® per DSC, il calcolo della resistenza termica avviene contemporaneamente a quello della temperatura e dell'entalpia, in modo che le curve risultanti mostrino automaticamente la vera temperatura all'interno del campione.
Misurazioni
Prima delle misure con il DSC 204 F1 Phoenix® , le Concavus® teglie di alluminio sono state lavate in acetone e riscaldate a 425°C per un minuto. Dopo aver inserito il campione (massa del campione 2,12 mg) nel crogiolo, questo è stato sigillato ermeticamente e posizionato nella cella DSC.
L'intervallo di temperatura deve essere scelto con cura per iniziare il riscaldamento ben prima dellaTemperature di fusione ed entalpieL'entalpia di fusione di una sostanza, nota anche come calore latente, è una misura dell'apporto di energia, tipicamente calore, necessario per convertire una sostanza dallo stato solido a quello liquido. Il punto di fusione di una sostanza è la temperatura alla quale essa cambia stato da solido (cristallino) a liquido (fusione isotropa). fusione, poiché il Temperature di fusione ed entalpieL'entalpia di fusione di una sostanza, nota anche come calore latente, è una misura dell'apporto di energia, tipicamente calore, necessario per convertire una sostanza dallo stato solido a quello liquido. Il punto di fusione di una sostanza è la temperatura alla quale essa cambia stato da solido (cristallino) a liquido (fusione isotropa).punto di fusione può essere abbassato dall'influenza delle impurità. Inoltre, è necessario considerare la prefusione, che è minima nei materiali molto puri ma può aumentare con l'aumentare della contaminazione.
Nel primo segmento, il campione è stato riscaldato da temperatura ambiente a 100°C con una velocità di riscaldamento di 20 K/min. Nel segmento successivo, la velocità di riscaldamento è stata diminuita a 0,7 K/min e la temperatura è stata aumentata a 130°C. Durante l'intero esperimento, la cella DSC è stata spurgata con azoto secco.
Risultati del test
La Figura 2 mostra la curva DSC del 2° segmento di riscaldamento. Il picco EndotermicoUna transizione campionaria o una reazione è endotermica se per la conversione è necessario il calore.endotermico deriva dallaTemperature di fusione ed entalpieL'entalpia di fusione di una sostanza, nota anche come calore latente, è una misura dell'apporto di energia, tipicamente calore, necessario per convertire una sostanza dallo stato solido a quello liquido. Il punto di fusione di una sostanza è la temperatura alla quale essa cambia stato da solido (cristallino) a liquido (fusione isotropa). fusione della Nipagina. La temperatura di insorgenza rilevata a 125,4°C è in buon accordo con il valore di letteratura per laTemperature di fusione ed entalpieL'entalpia di fusione di una sostanza, nota anche come calore latente, è una misura dell'apporto di energia, tipicamente calore, necessario per convertire una sostanza dallo stato solido a quello liquido. Il punto di fusione di una sostanza è la temperatura alla quale essa cambia stato da solido (cristallino) a liquido (fusione isotropa). temperatura di fusione (125,2°C [1]).
Per il calcolo della purezza è stata utilizzata l'equazione di Van't Hoff, come descritto nel metodo A dell'ASTM E928-08:
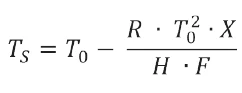
TS: temperatura del campione [K]
T0: temperatura diTemperature di fusione ed entalpieL'entalpia di fusione di una sostanza, nota anche come calore latente, è una misura dell'apporto di energia, tipicamente calore, necessario per convertire una sostanza dallo stato solido a quello liquido. Il punto di fusione di una sostanza è la temperatura alla quale essa cambia stato da solido (cristallino) a liquido (fusione isotropa). fusione del Nipagin puro [K]
R: costante del gas (= 8,314 J/mol-1-K-1)
X: frazione mol dell'impurezza
H: calore di fusione [J-mol-1], calcolato dall'area del picco
F: frazione fusa
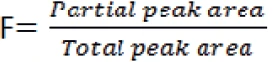
Il diagramma di Van't Hoff è una visualizzazione grafica dei dati di purity determination. Esso confronta i dati di misurazione effettivi per 1/F (il reciproco della frazione del picco di fusione) con la temperatura alla quale si osserva tale quantità di fusione. Questi dati sono generalmente non lineari; la non linearità aumenta con la diminuzione della purezza. La deviazione dalla linearità è causata dalla prefusione, che non può essere rilevata con la DSC. Si noti che la curvatura è influenzata dal programma di temperatura della misurazione DSC (inizio troppo vicino al picco di fusione) e dai limiti per il calcolo dell'area del picco (ad esempio, limite sinistro troppo vicino al picco di fusione).
Per la linearizzazione della curva, il software calcola un valore rivisto per F aggiungendo un fattore di correzione c all'area totale e a ciascuna area frazionaria. Questa procedura consente di ottenere la linearità della curvaTs=f(1/F).
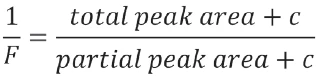
Inoltre, il peso molecolare deve essere inserito nel software per calcolare il valore mole%.
La Figura 3 mostra i dati osservati e quelli corretti (curva lineare).
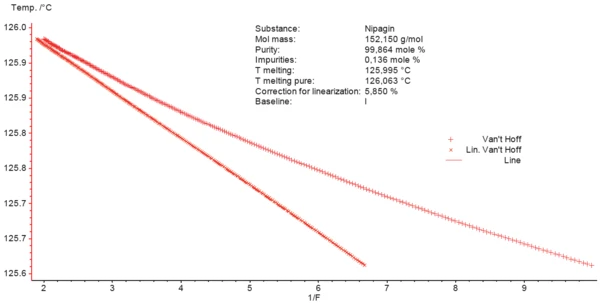
La purezza è calcolata dalla pendenza dei dati lineari corretti. Il Temperature di fusione ed entalpieL'entalpia di fusione di una sostanza, nota anche come calore latente, è una misura dell'apporto di energia, tipicamente calore, necessario per convertire una sostanza dallo stato solido a quello liquido. Il punto di fusione di una sostanza è la temperatura alla quale essa cambia stato da solido (cristallino) a liquido (fusione isotropa).punto di fusione teorico del materiale puro al 100% può essere ottenuto dal grafico come il punto in cui la frazione fusa (1/F) è 0 (T di fusione pura nel riquadro della Figura 3). Tale valore è pari a 126,063°C rispetto allaTemperature di fusione ed entalpieL'entalpia di fusione di una sostanza, nota anche come calore latente, è una misura dell'apporto di energia, tipicamente calore, necessario per convertire una sostanza dallo stato solido a quello liquido. Il punto di fusione di una sostanza è la temperatura alla quale essa cambia stato da solido (cristallino) a liquido (fusione isotropa). temperatura di fusione di 125,995°C. Il software NETZSCH Purity calcola il contenuto di impurità del campione Nipagin misurato come 0,14 mole-%.
I risultati sono affidabili solo quando i dati aggiustati mostrano linearità, il livello di purezza è superiore al 98,5% e il fattore di correzione c è inferiore al 20% [3].
Dopo la misurazione, il campione è stato pesato di nuovo per garantire che non si sia verificata alcuna perdita di massa durante la misurazione. Una variazione della massa iniziale indicherebbe l'evaporazione dei volatili, con conseguente effetto EndotermicoUna transizione campionaria o una reazione è endotermica se per la conversione è necessario il calore.endotermico. Pertanto, il picco EndotermicoUna transizione campionaria o una reazione è endotermica se per la conversione è necessario il calore.endotermico non sarebbe causato solo dalla fusione, ma anche dal rilascio di volatili. Questo falserebbe la valutazione del picco.
Conclusione
Il metodo DSC consente di determinare facilmente la purezza dei materiali cristallini puri. La purezza viene calcolata in base al tasso di fusione del materiale in esame. Dal picco di fusione DSC si determina la depressione del Temperature di fusione ed entalpieL'entalpia di fusione di una sostanza, nota anche come calore latente, è una misura dell'apporto di energia, tipicamente calore, necessario per convertire una sostanza dallo stato solido a quello liquido. Il punto di fusione di una sostanza è la temperatura alla quale essa cambia stato da solido (cristallino) a liquido (fusione isotropa).punto di fusione, che è direttamente correlata alla presenza di impurità.
Un prerequisito per purity determination mediante DSC è che le impurità si dissolvano nella fusione e siano insolubili nel cristallo. Per un corretto purity determination, occorre anche evitare la sublimazione del campione.