Introduzione
Il sorbitolo è un alcool zuccherino presente nella frutta, spesso utilizzato come dolcificante nei prodotti alimentari. Esiste in quattro fasi cristalline anidre più l'idrato. Questo PolimorfismoIl polimorfismo è la capacità di un materiale solido di formare diverse strutture cristalline (sinonimi: forme, modificazioni).polimorfismo influisce sulle proprietà di questa sostanza: Ogni forma si comporta in modo diverso per quanto riguarda laTemperature di fusione ed entalpieL'entalpia di fusione di una sostanza, nota anche come calore latente, è una misura dell'apporto di energia, tipicamente calore, necessario per convertire una sostanza dallo stato solido a quello liquido. Il punto di fusione di una sostanza è la temperatura alla quale essa cambia stato da solido (cristallino) a liquido (fusione isotropa). fusione e l'assorbimento di acqua [1].
Condizioni di prova
Un campione di sorbitolo (massa: 3,81 mg) di Sigma-Aldrich è stato preparato in un crogiolo Concavus® e misurato con il DSC 204 F1 Nevio . È stato effettuato un riscaldamento iniziale tra -80°C e 150°C a una velocità di riscaldamento di 10 K/min. Poi il campione è stato raffreddato a 10 K/min e riscaldato nuovamente nello stesso intervallo di temperatura. Successivamente, il crogiolo è stato tenuto per 24 ore a temperatura ambiente, prima di essere misurato una terza volta tra -80°C e 150°C alle stesse condizioni. Le misure DSC sono state effettuate in atmosfera dinamica di azoto.
Inoltre, sono state eseguite misure PXRD su due stati del campione:
- Campione come ricevuto
- Campione dopo il riscaldamento a 150°C e 24 ore a temperatura ambiente
Queste misure sono state effettuate con il diffrattometro Bruker D8 Advance presso solid-chem GmbH.
Risultati del test
La Figura 2 mostra le curve DSC del sorbitolo durante i tre riscaldamenti. Il picco EndotermicoUna transizione campionaria o una reazione è endotermica se per la conversione è necessario il calore.endotermico con una temperatura di insorgenza estrapolata di 91°C, rilevato durante il primo riscaldamento, deriva dallaTemperature di fusione ed entalpieL'entalpia di fusione di una sostanza, nota anche come calore latente, è una misura dell'apporto di energia, tipicamente calore, necessario per convertire una sostanza dallo stato solido a quello liquido. Il punto di fusione di una sostanza è la temperatura alla quale essa cambia stato da solido (cristallino) a liquido (fusione isotropa). fusione del campione. Questa temperatura è tipica della modifica nota come forma gamma, che è la più adatta per le applicazioni commerciali perché è la più stabile.
Dopo il raffreddamento a 10 K/min, non è stato rilevato alcun picco diTemperature di fusione ed entalpieL'entalpia di fusione di una sostanza, nota anche come calore latente, è una misura dell'apporto di energia, tipicamente calore, necessario per convertire una sostanza dallo stato solido a quello liquido. Il punto di fusione di una sostanza è la temperatura alla quale essa cambia stato da solido (cristallino) a liquido (fusione isotropa). fusione durante il secondo riscaldamento: Il campione non presenta più alcuna fase cristallina e si trova in uno stato amorfo con transizione vetrosa a -1°C (temperatura media).
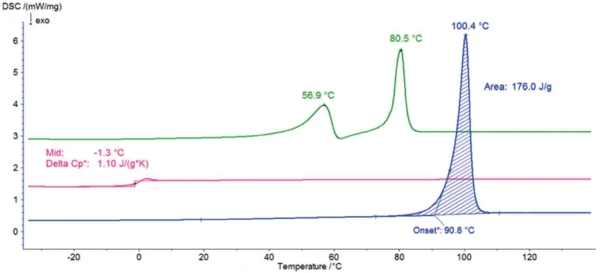
Un giorno a temperatura ambiente è sufficiente per consentire la CristallizzazioneLa cristallizzazione è il processo fisico di indurimento durante la formazione e la crescita dei cristalli. Durante questo processo viene rilasciato il calore di cristallizzazione.cristallizzazione. Tuttavia, i picchi rilevati a 57°C e 81°C (temperature di picco) dimostrano che si tratta di una forma cristallina diversa da quella rilevata durante il primo riscaldamento. Questa curva DSC è tipica della modifica chiamataTemperature di fusione ed entalpieL'entalpia di fusione di una sostanza, nota anche come calore latente, è una misura dell'apporto di energia, tipicamente calore, necessario per convertire una sostanza dallo stato solido a quello liquido. Il punto di fusione di una sostanza è la temperatura alla quale essa cambia stato da solido (cristallino) a liquido (fusione isotropa). fusione cristallizzata. Questa forma è più igroscopica di quella gamma. Tuttavia, viene utilizzata a livello commerciale per il suo aspetto trasparente e vetroso, ad esempio nella produzione di caramelle dure.
Le temperature diTemperature di fusione ed entalpieL'entalpia di fusione di una sostanza, nota anche come calore latente, è una misura dell'apporto di energia, tipicamente calore, necessario per convertire una sostanza dallo stato solido a quello liquido. Il punto di fusione di una sostanza è la temperatura alla quale essa cambia stato da solido (cristallino) a liquido (fusione isotropa). fusione delle forme cristalline misurate in questo lavoro sono confrontate con diverse fonti della letteratura nella tabella 1.
Tabella 1: Temperature di picco delle forme cristalline: fusione cristallina, alfa, gamma e temperature di transizione vetrosa della forma amorfa per questo lavoro e per diverse fonti.
| Forma/Temperatura [°C] | Questo lavoro | Fonte [1] | Fonte [3] | Fonte [4] | Fonte [5] |
|---|---|---|---|---|---|
| Fusione cristallizzata (1° picco) | 56.9 | 54.5 | 55 | - | - |
| Fusione cristallizzata (2° picco) | 80.5 | 70.8 | 75 | - | - |
| Alfa | - | 85.9 | 86 | 88.5 | - |
| Gamma | 100.4 | 98.0 | 97 | 100 | 101.7 |
| Amorfo | -1.3 | - | - | - | -0.4 |
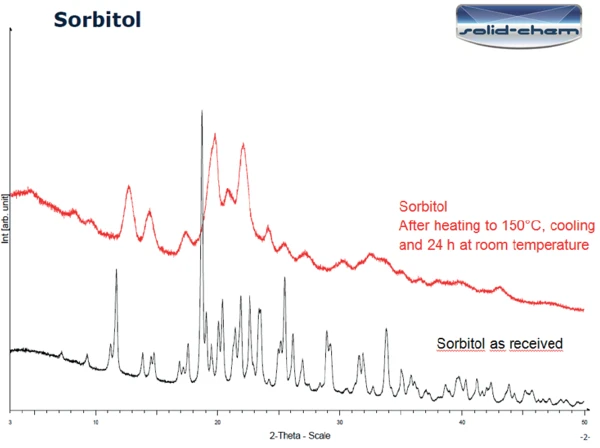
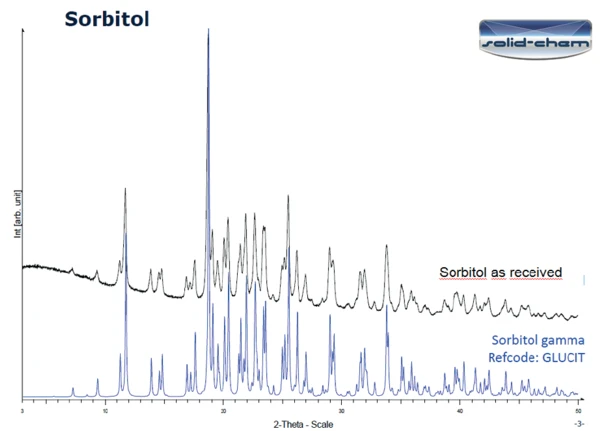
La Figura 3 mostra i risultati della PXRD sul campione ricevuto (in basso) e sul campione dopo il riscaldamento a 150°C seguito da 24 ore a temperatura ambiente (in alto). Le due curve differiscono in modo significativo. I picchi rilevati nella misurazione del campione ricevuto corrispondono alla forma gamma del sorbitolo (figura 4). Secondo la letteratura ([1], figura 6 [modello di diffrazione di polvere a raggi X del polimorfo fuso cristallizzato del sorbitolo]), la curva dopo il riscaldamento a 150°C e un giorno a temperatura ambiente può effettivamente essere classificata come la forma fusa cristallizzata del sorbitolo.
Conclusione
Un solo riscaldamento con il DSC 204 F1 Nevio permette di identificare la forma polimorfa del sorbitolo fornito. Durante il raffreddamento della forma gamma a 10 K/min dalla fusione, il sorbitolo non cristallizza ma forma una fase amorfa. Questa struttura amorfa può cristallizzare a temperatura ambiente come una nuova modifica chiamata fusione cristallizzata. Questi risultati sono stati confermati dalle misure PXRD.
Ogni modifica del sorbitolo ha proprietà fisiche diverse. Per questo motivo devono essere caratterizzate prima della lavorazione. Il DSC 204 F1 Nevio fornisce i risultati necessari in modo semplice, rapido e affidabile.
Riconoscimento
NETZSCH desiderano ringraziare la solid-chem GmbH di Bochum, Germania, per aver effettuato le misurazioni e la valutazione PXRD.