Introdução
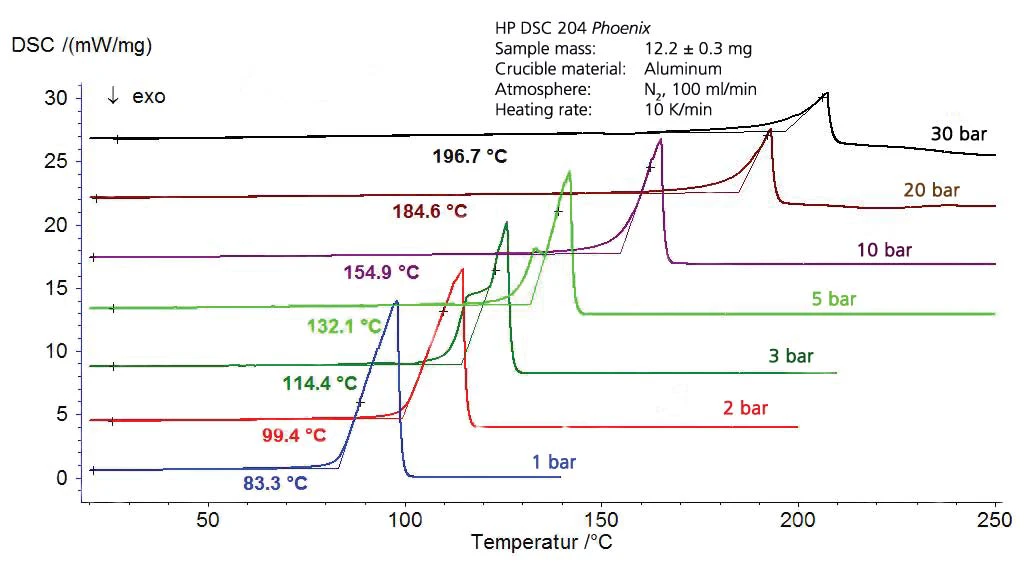
A Calorimetria Exploratória Diferencial (DSC) permite não apenas a determinação das temperaturas de transformação de fase, mas também a quantificação das entalpias de transformação. Em geral, as amostras são analisadas em cadinhos de alumínio com uma tampa perfurada sob pressão atmosférica em um fluxo constante de gás de purga. Com instrumentos modificados, em que a célula de medição é instalada em uma autoclave (o chamado DSC de pressão), também é possível fazer medições em uma faixa de pressão entre 5 kPa e 15 MPa [1]. Nesta nota de aplicação, os líquidos são analisados com relação ao seu comportamento de evaporação nessa faixa de pressão.
Como a evaporação de líquidos antes de atingir a temperatura de ebulição e o equilíbrio entre líquido e gás durante a ebulição são parâmetros críticos, que podem ter influência negativa sobre a reação e a avaliação posterior, foram empregados cadinhos especiais para essas medições. Foi feita uma boa experiência com esses cadinhos de alumínio soldados a frio com um orifício defi small nido com um diâmetro de 50 μm.
A equação de Antoine descreve a relação entre a pressão de vapor de saturação de uma substância pura e a temperatura:
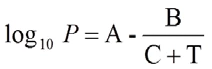
em que P é a pressão em bar, T é a temperatura em K e as variáveis A, B e C são constantes específicas do componente. Essas, no entanto, não podem ser usadas para descrever todo o processo da curva do ponto de ebulição de uma substância. Portanto, há vários conjuntos de parâmetros para a faixa que vai do ponto triplo ao ponto crítico.
A tabela a seguir resume os líquidos investigados: água, ciclohexano, acetato de etila e isopropanol para a faixa de validade dos dados de literatura usados:
Tabela 1: Faixa de temperatura e coeficientes da equação de Antoine [3, 4, 5]
| Substância | Faixa de temperatura [K] | Faixa de temperatura [°C] | A | B | C |
|---|---|---|---|---|---|
| H2O | 313 ... 385 | 40 ... 112 | 6.1680 | 1397.2 | -48.097 |
| C6H12 | 323 ... 523 | 50 ... 250 | 4.1398 | 1316.5 | -35.581 |
| C4H8O2 | 288 ... 348 | 15 ... 75 | 4.2280 | 1245.7 | -55.189 |
| C3H8O | 395 ... 508 | 122 ... 235 | 4.5779 | 1221.4 | -87.474 |
Resultados
Água
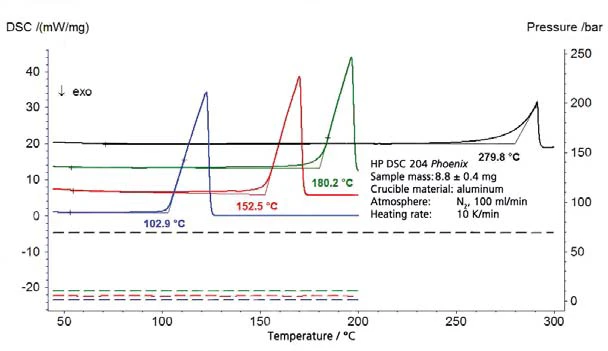
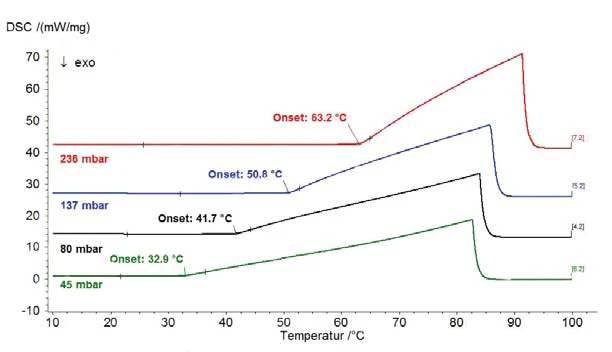
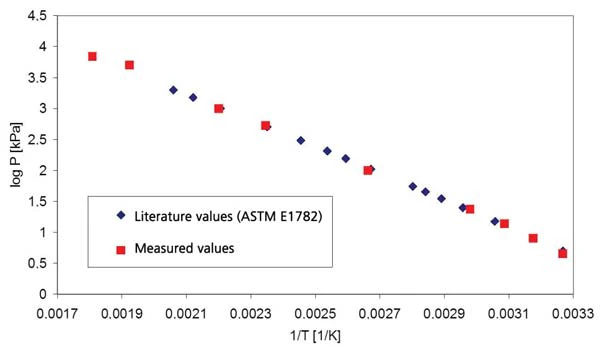
Os resultados em água destilada para a faixa de pressão acima da pressão atmosférica são mostrados na figura 1 (pressão mostrada com linhas tracejadas); a figura 2 mostra a faixa de pressão entre 45 mbar e 236 mbar. A Figura 3 mostra a boa concordância dos dados da literatura de [2] (ASTM E782) com todos os valores de medição determinados.
Ciclohexano
Os resultados para o ciclohexano na faixa de temperatura entre -20°C e 300°C (figura 4) incluem tanto a ebulição quanto aTemperaturas e entalpias de fusãoA entalpia de fusão de uma substância, também conhecida como calor latente, é uma medida da entrada de energia, normalmente calor, necessária para converter uma substância do estado sólido para o líquido. O ponto de fusão de uma substância é a temperatura na qual ela muda de estado, passando do sólido (cristalino) para o líquido (fusão isotrópica). fusão. Isso resulta no segmento do diagrama de fase, apresentado na figura 5. A Figura 6 mostra a comparação com a literatura [3].
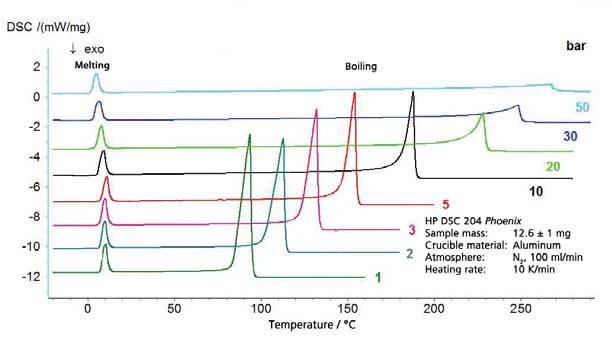
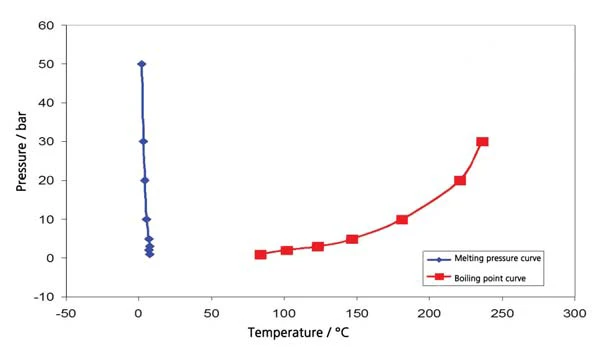
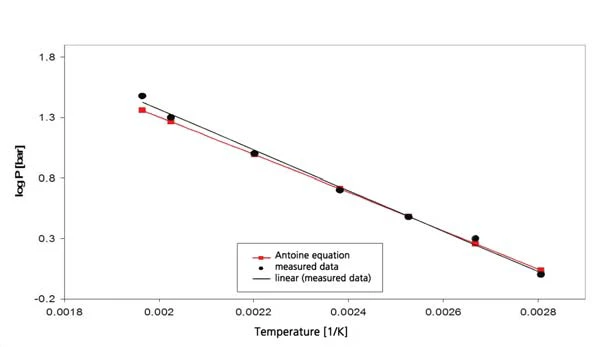
Acetato de etila
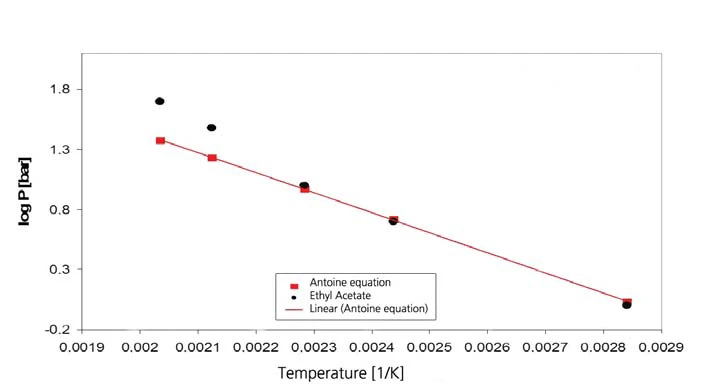
Os resultados para o acetato de etila são mostrados nas figuras 7 e 8. Os valores da literatura, no entanto, são valores extrapolados, pois a faixa de validade da equação de Antoine de [4] é limitada ao intervalo entre 15 °C e 75 °C (288 K a 348 K, correspondendo aos valores de temperatura recíproca de 0,00347 a 0,00287).
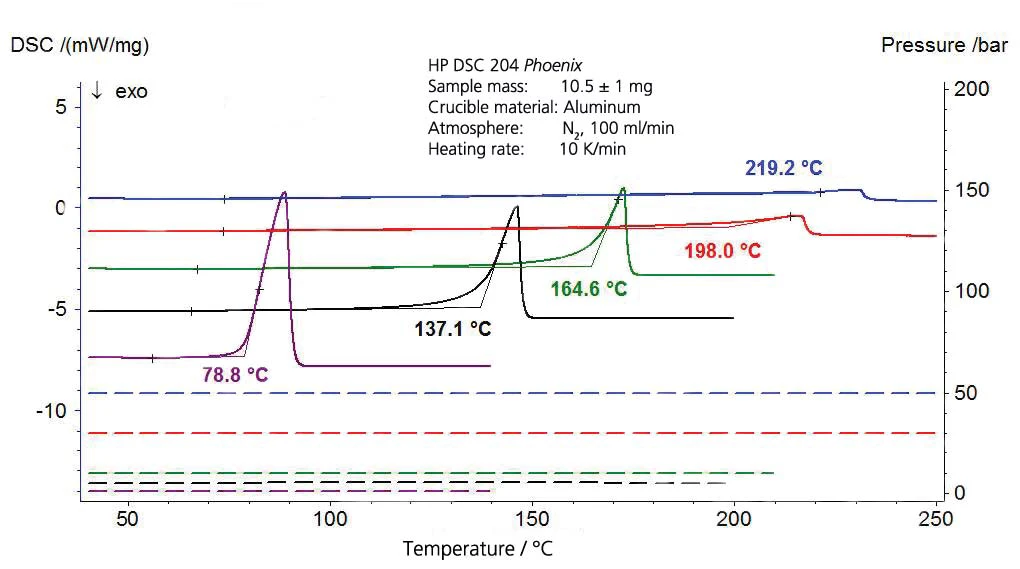
Isopropanol
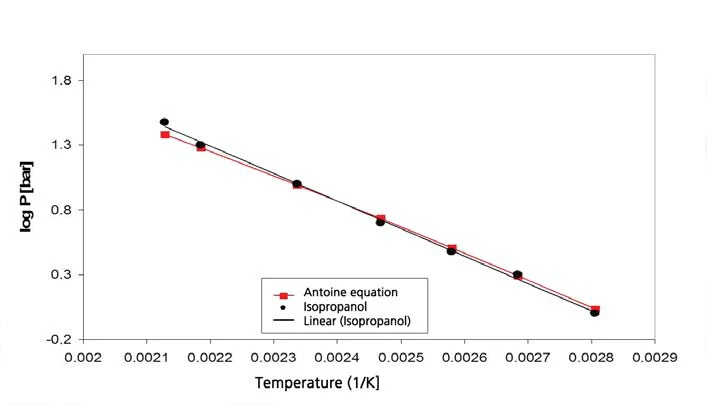
As Figuras 9 e 10 mostram os resultados da medição e a comparação dos valores da literatura [5] para o isopropanol.
Resumo
A Calorimetria Exploratória Diferencial (DSC), combinada com a possibilidade de variações de pressão dentro da célula de medição, permite a investigação da dependência da pressão das transformações de fase. Os resultados da transição líquido-gaseosa das substâncias investigadas, água, ciclohexano, acetato de etila e isopropanol, estão de acordo com a literatura.