Introduzione
La calorimetria differenziale a scansione (DSC) non consente solo di determinare le temperature di trasformazione delle fasi, ma anche di quantificare le entalpie di trasformazione. I campioni vengono generalmente analizzati in crogioli di alluminio con coperchio forato a pressione atmosferica in un flusso costante di gas di lavaggio. Con strumenti modificati, in cui la cella di misura è installata in un'autoclave (un cosiddetto DSC a pressione), sono possibili anche misure in un intervallo di pressione compreso tra 5 kPa e 15 MPa [1]. In questa nota applicativa, i liquidi vengono analizzati in relazione al loro comportamento di evaporazione in questo intervallo di pressione.
Poiché l'evaporazione dei liquidi prima di raggiungere la temperatura di ebollizione e l'equilibrio tra liquido e gas durante l'ebollizione sono parametri critici, che possono influenzare negativamente la reazione e la successiva valutazione, per queste misure sono stati utilizzati crogioli speciali. È stata fatta una buona esperienza con questi crogioli di alluminio saldati a freddo con un foro definito da small con un diametro di 50 μm.
L'equazione di Antoine descrive la relazione tra la pressione di saturazione del vapore di una sostanza pura e la temperatura:
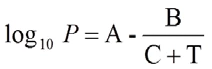
dove P è la pressione in bar, T è la temperatura in K e le variabili A, B e C sono costanti specifiche del componente. Queste, tuttavia, non possono essere utilizzate per descrivere l'intero processo della curva del punto di ebollizione di una sostanza. Pertanto, esistono diversi set di parametri per l'intervallo dal punto triplo al punto critico.
La tabella seguente riassume i liquidi studiati, acqua, cicloesano, acetato di etile e isopropanolo, per l'intervallo di validità dei dati di letteratura utilizzati:
Tabella 1: Intervallo di temperatura e coefficienti dell'equazione di Antoine [3, 4, 5]
| Sostanza | Intervallo di temperatura [K] | Intervallo di temperatura [°C] | A | B | C |
|---|---|---|---|---|---|
| H2O | 313 ... 385 | 40 ... 112 | 6.1680 | 1397.2 | -48.097 |
| C6H12 | 323 ... 523 | 50 ... 250 | 4.1398 | 1316.5 | -35.581 |
| C4H8O2 | 288 ... 348 | 15 ... 75 | 4.2280 | 1245.7 | -55.189 |
| C3H8O | 395 ... 508 | 122 ... 235 | 4.5779 | 1221.4 | -87.474 |
Risultati
Acqua
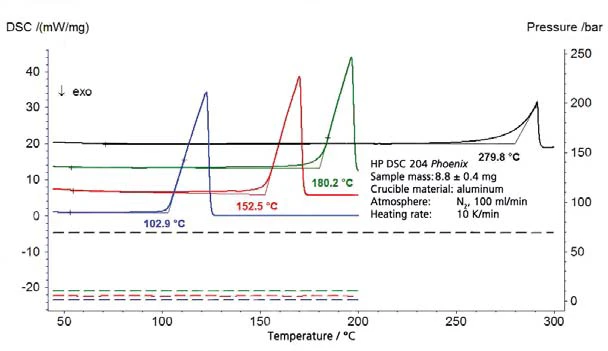
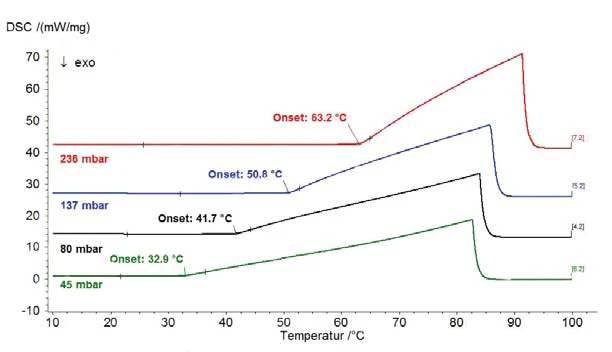
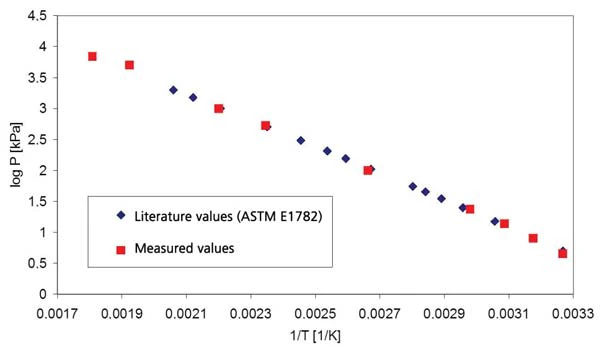
I risultati relativi all'acqua distillata per l'intervallo di pressione superiore alla pressione atmosferica sono riportati nella figura 1 (pressione indicata con linee tratteggiate); la figura 2 mostra l'intervallo di pressione compreso tra 45 mbar e 236 mbar. La figura 3 mostra il buon accordo dei dati di letteratura di [2] (ASTM E782) con tutti i valori di misura determinati.
Cicloesano
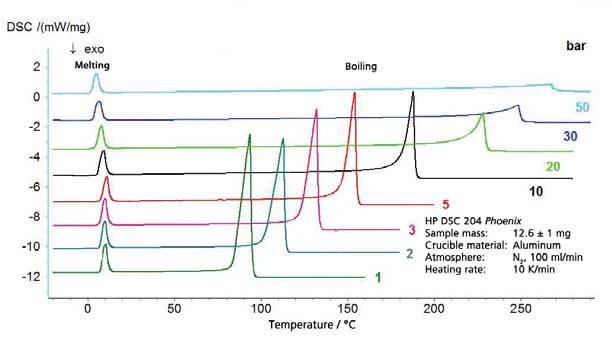
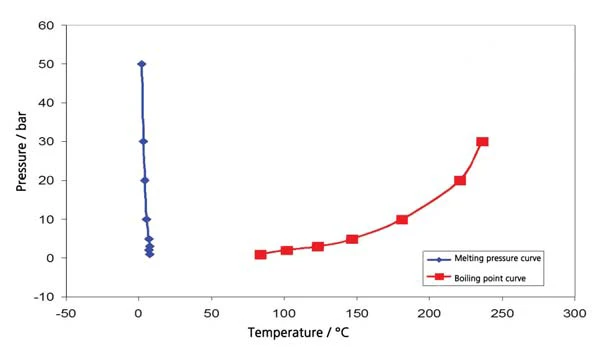
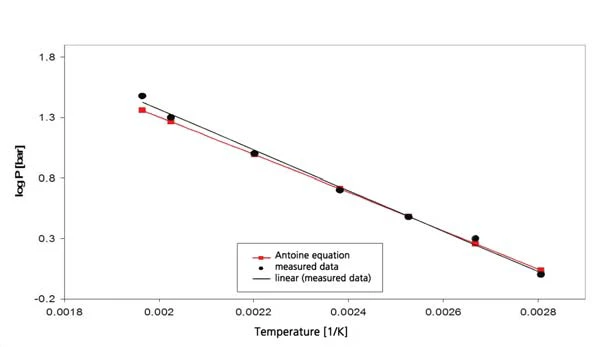
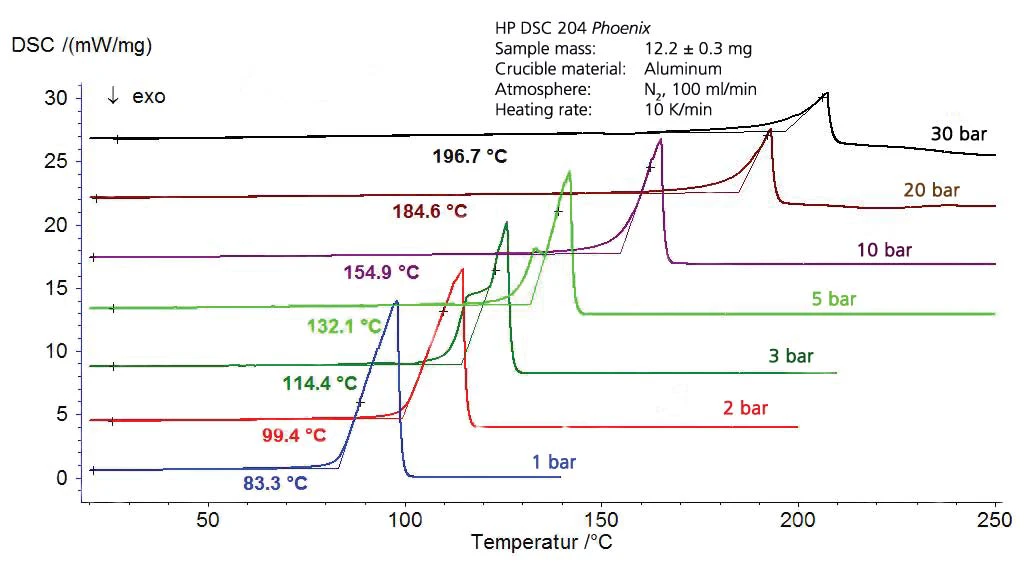
I risultati per il cicloesano nell'intervallo di temperatura compreso tra -20°C e 300°C (figura 4) comprendono sia l'ebollizione che laTemperature di fusione ed entalpieL'entalpia di fusione di una sostanza, nota anche come calore latente, è una misura dell'apporto di energia, tipicamente calore, necessario per convertire una sostanza dallo stato solido a quello liquido. Il punto di fusione di una sostanza è la temperatura alla quale essa cambia stato da solido (cristallino) a liquido (fusione isotropa). fusione. Ne consegue il segmento del diagramma di fase, presentato in figura 5. La figura 6 mostra il confronto con la letteratura [3].
Acetato di etile
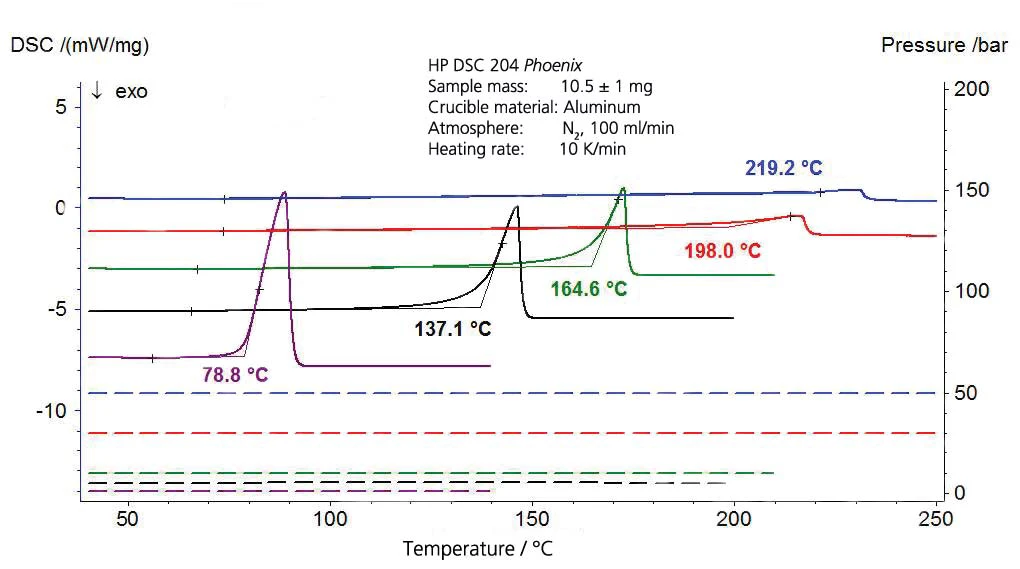
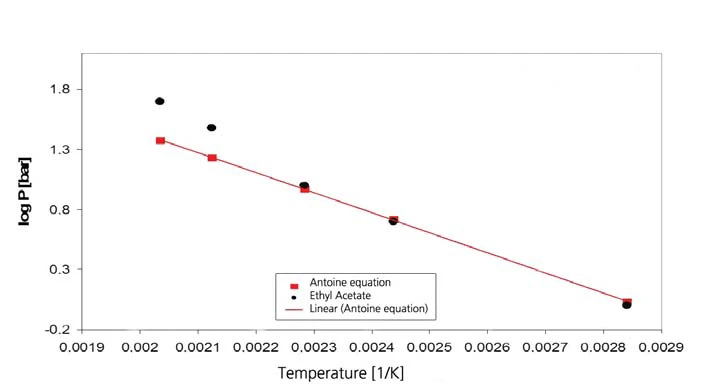
I risultati relativi all'acetato di etile sono riportati nelle figure 7 e 8. I valori di letteratura, tuttavia, sono valori estrapolati poiché l'intervallo di validità dell'equazione di Antoine di [4] è limitato all'intervallo tra 15°C e 75°C (da 288 K a 348 K, corrispondenti ai valori reciproci di temperatura di 0,00347 e 0,00287).
Isopropanolo
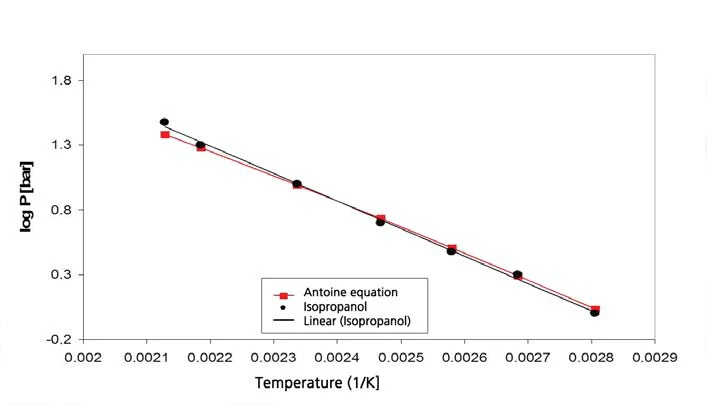
Le figure 9 e 10 mostrano i risultati delle misure e il confronto con i valori di letteratura [5] per l'isopropanolo.
Sintesi
La calorimetria differenziale a scansione (DSC), combinata con la possibilità di variazioni di pressione all'interno della cella di misura, consente di studiare la dipendenza dalla pressione delle trasformazioni di fase. I risultati per la transizione liquido-gassosa delle sostanze studiate, acqua, cicloesano, acetato di etile e isopropanolo, sono in ottimo accordo con la letteratura.