Einleitung
In der Pharmazie gibt es kaum einen Wirkstoff, über den mehr geschrieben wurde als über Acetysalicylsäure (oder kurz ASS; im englischsprachigen Raum wird der Markenname Aspirin™ sogar oft als Synonym verwendet). Die Erfolgsgeschichte von Aspirin begann Ende des 19. Jahrhunderts, als Dr. Felix Hoffmann die Substanz in den BAYER-Laboren erstmals ohne Verunreinigungen synthetisierte. Bis heute ist es eines der beliebtesten Arzneimittel, das in einem breiten therapeutischen Spektrum eingesetzt wird. Es gehört zur Gruppe der nichtsteroidalen, entzündungshemmenden Antirheumatika (NSAIDs) und wird zur Behandlung von Schmerzen, Fieber und Entzündungen eingesetzt. Außerdem wird es zur Vorbeugung eines erneuten Herzinfarkts oder Schlaganfalls bei Risikopatienten angewandt. 1977 wurde ASS als Analgetikum in die “Liste der unentbehrlichen Arzneimittel“ der WHO (Weltgesundheitsorganisation) aufgenommen. [1]
Dies ist das erste von vier Application Notes, die das thermische Verhalten von Acetylsalicylsäure näher untersuchen: Zersetzung in unterschiedlichen Gasatmosphären, Zersetzungskinetik und die entstehenden Gasspezies. [2, 3, 4]
Tabelle 1: STA-Messparameter
| Parameter | Acetylsalicylsäure |
| Probeneinwaage | 4,96 mg |
| Atmosphäre | Helium |
| Tiegel | Al2O3, 85 μl, offen |
| Temperaturprogramm | RT bis 450 °C, 10 K/min |
| Spülgasrate | 100 ml/min |
| Probenhalter | TGA, Typ S |
Ergebnisse und Diskussion
Zur Untersuchung der thermischen Zersetzung von Acetylsalicylsäure wurden thermogravimetrische Messungen (TG) mit der NETZSCH STA 449 F3 Jupiter®, gekoppelt an ein GC-MS-System (Agilent 8890 Gaschromatograph und das Agilent 5975 MSD) durchgeführt. Als Spülgasatmosphäre wurden mehrere Gase, z.B. Helium, verwendet. Detailliertere Informationen zu den Messbedingungen sind in Tabelle 1 zusammengefasst.
Die Pyrolyse von Acetylsalicylsäure weist zwei Massenverluststufen (siehe Abbildung 1) auf. Der erste Massenverlust von 66,4 % ist mit einem Peak in der Massenverlustrate (DTG) bei 170 °C verbunden. Die zweite Massenverluststufe beträgt 33,4 % mit einem Peak in der DTG-Kurve bei 327 °C.
Um einen Einblick in die Pyrolyseprodukte zu erhalten, wurde die TG-GC-MS-Kopplung eingesetzt. Das komplexe Gasgemisch wird aufgetrennt und die verschiedenen Komponenten können identifiziert werden. Die Messparameter für das GC-MS sind in Tabelle 2 beschrieben.
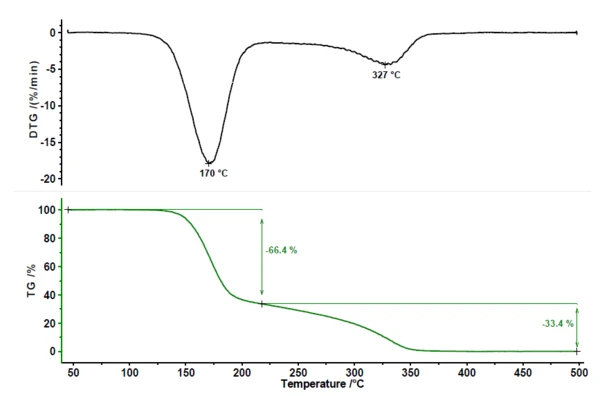
Tabelle 2: GC-MS-Messparameter
| Parameter | Kühlfallenmodus |
| Säule | Agilent HP-5ms |
| Säulenlänge | 30 m |
| Säulendurchmesser | 0,25 mm |
| Kühlfalle | -50 °C, 45 min |
| Säulentemperatur | 40 °C, IsothermUntersuchungen bei geregelter und konstanter Temperatur werden als isotherm bezeichnet.isotherm, 48 min 40 °C bis 300 °C, 15 K/min |
| Gasatmosphäre | He |
| Säulenfluss (Split) | 2 ml/min (5:1) |
| Ventilschaltungen | jede Minute |
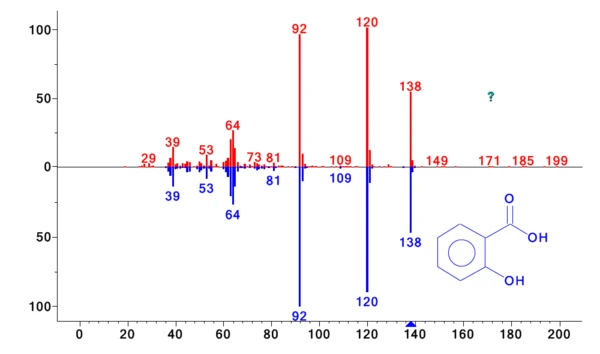
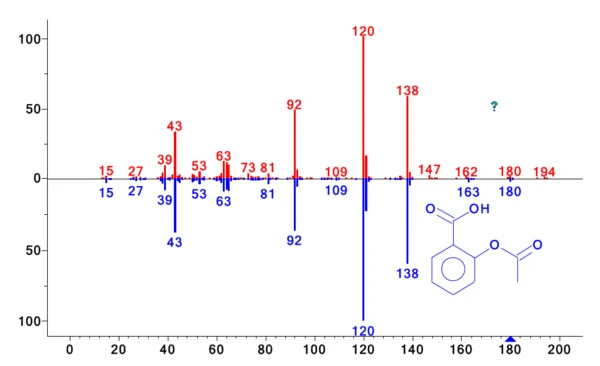
Die freigesetzten Gase wurden im Minutentakt auf die Kühlfalle abgeleitet. Erst nach der thermogravimetrischen Messung wurde die Kühlfalle von -50 °C bis 300 °C mit einer Heizrate von 300 K/min aufgeheizt, um die kondensierten Verbindungen zu verdampfen und über die GC-Säule zu trennen (Aufheizen der Säule mit 15 K/min). Diese Methode erhöht die Konzentration der Nebenprodukte und ermöglicht eine ausgezeichnete Trennung. Der resultierende Gesamtionenstrom ist in Abbildung 2 dargestellt. Der Vergleich der detektierten MS-Spektren für jeden Peak mit der NIST-Bibliothek ergibt eine Reihe von Verbindungen mit ausgezeichneter Trefferqualität. Die Identifizierung ist beispielhaft für die Peaks mit einer Retentionszeit von 59,31 min und 60,89 min in den Abbildungen 3 und 4 aufgezeigt. Neben Essigsäure, Phenol, Salicylsäure und Acetylsalicylsäure wurden auch die in der Literatur angegebenen zyklischen Oligomere der 2-Hydroxybenzoesäure gefunden [5]. Diese Analyse zeigt, dass sowohl Zersetzung als auch VerdampfungVerdampfung beschreibt die Phasenumwandlung eines Stoffes von der flüssigen in die gasförmige Phase. Beim Verdampfen eines Stoffes unterscheidet man grundsätzlich zwei Formen, Sieden und Verdunstung.Verdampfung gleichzeitig stattfinden und erklärt zudem, warum die beiden Massenverluststufen nicht getrennt sind.
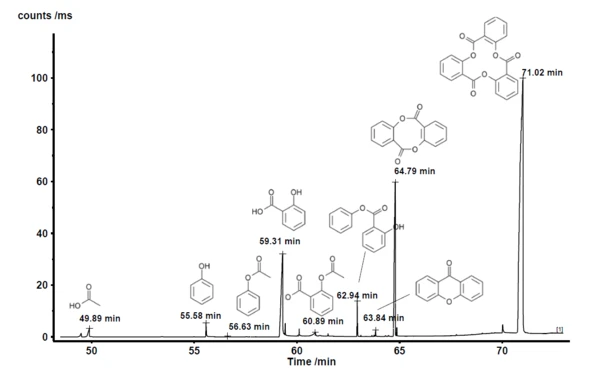
Bibliothekssuche
| Retentionszeit [min] | Name | Trefferqualität |
| 49,89 | Essigsäure | 91 |
| 55,58 | Phenol | 96 |
| 56,63 | Essigsäure Phenylester | 90 |
| 59,31 | 2-Hydroxybenzoesäure (= Salicylsäure) | 97 |
| 60,89 | Acetylsalicylsäure | 81 |
| 62,94 | Phenylsalicylat | 95 |
| 63,84 | Xanthon | 97 |
| 64,79 | 6H,12H-Dibenzo[b,f][1,5]dioxocin-6,12-dione (Dimer von 2-Hydroxybenzoesäure) | 64 |
| 71,02 | 2,10,18-Trioxatetracyclo[18.4.0.0(4,9).0(12,17)] tetracosa-1(24),4,6,8,12,14,16,20,22-nonaene-3,11, 19-trione (Trimer von 2-Hydroxybenzoesäure) | 90 |
Zusammenfassung
Die Kombination von Thermogravimetrie und GC-MS (Gaschromatographie-Massenspektrometrie) ist eine leistungsfähige Technik, um einen tiefen Einblick in thermische Zersetzungsprozesse und die dabei freigesetzten Gase zu erhalten. Die thermische Zersetzung von Acetylsalicylsäure in Heliumatmosphäre führt zur Freisetzung eines komplexen Gasgemisches aus mindestens neun Verbindungen. Frühere Untersuchungen mittels TG-FTIR (Fourier-Transform-Infrarot-Spektroskopie, gekoppelt mit einer Thermowaage) zeigten, dass in der ersten Massenverluststufe Essigsäure und Salicylsäure freigesetzt werden, während die zweite Massenverluststufe auf eine komplexe ZersetzungsreaktionEine Zersetzungsreaktion ist eine thermisch induzierte Reaktion einer chemischen Substanz, die fest und/oder gasförmige Zersetzungsprodukte bildet.Zersetzungsreaktion zurückzuführen ist. Die Fähigkeit der GC-MS setzt dort an, wo FT-IR an seine Grenzen stößt und ermöglicht einen viel tieferen Einblick in das Gemisch der gleichzeitig freigesetzten Gase. Mittels TG-GC-MS konnten diese getrennt und identifiziert werden.