Einleitung
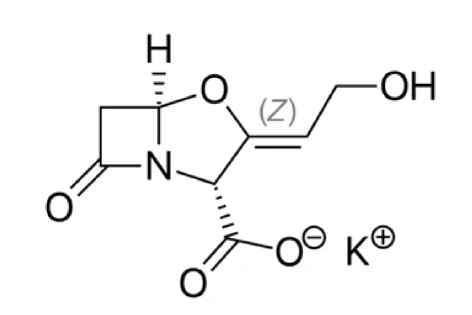
Kaliumclavulanat ist ein Salz der Clavulansäure. Es ist ein halbsynthetischer ß-Lactamase-Inhibitor, enthält einen ß-Lactam-Ring und bindet stark an ß-Lactamase an oder in der Nähe seines aktiven Zentrums. Es hilft zu verhindern, dass bestimmte Bakterien gegen das Antibiotikum Amoxicillin resistent werden. Daher wird das Medikament in Verbindung mit ß-Lactamase-sensitiven Penicillinen zur Behandlung von Infektionen eingesetzt, die durch ß-Lactamase-produzierende Organismen verursacht werden [1, 3]. Kaliumclavulanat erfordert eine Lagerung bei tiefen Temperaturen.
Kenntnisse über den Zersetzungsverlauf von Kaliumclavulanat helfen bei der Optimierung von Lagerungsbedingungen und Verbesserung der Langzeitstabilität.
Messbedingungen
Die TGA-Messung wurde mit der TG 209 F1 Libra®, gekoppelt an den Bruker Optik FT-IR Tensor II, durchgeführt. Zur Untersuchung wurden 10,51 mg Kaliumclavulanat im offenen Tiegel von Raumtemperatur bis 600 °C mit einer Heizrate von 10 K/min und unter Stickstoffatmosphäre (40 ml/min) aufgeheizt. Zur Identifizierung wurden die freigesetzten Gase über eine beheizte Teflon-Transferleitung direkt in die Gaszelle des FT-IRSpektrometers überführt.
Messergebnisse
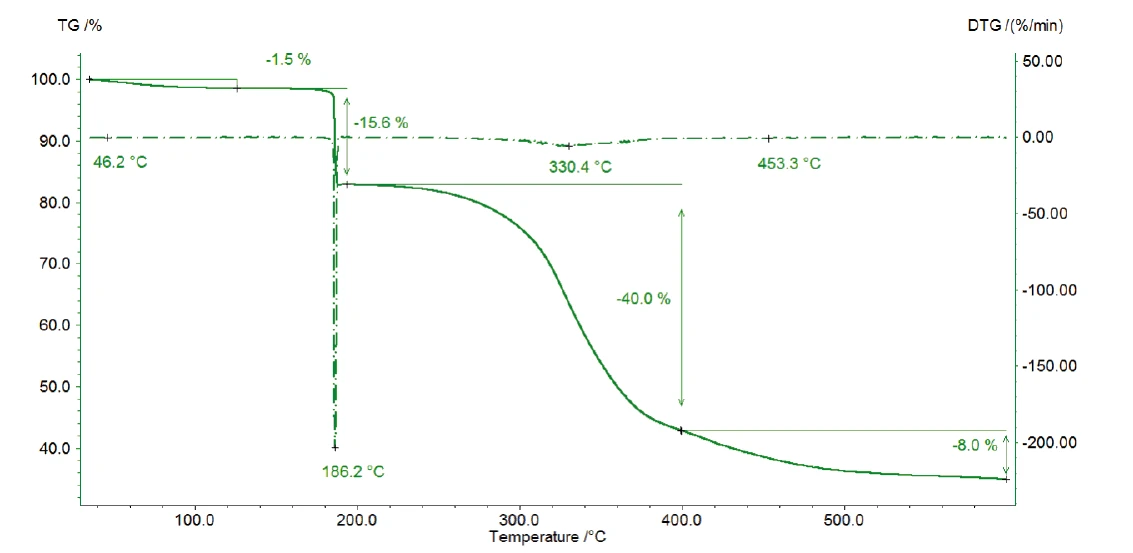
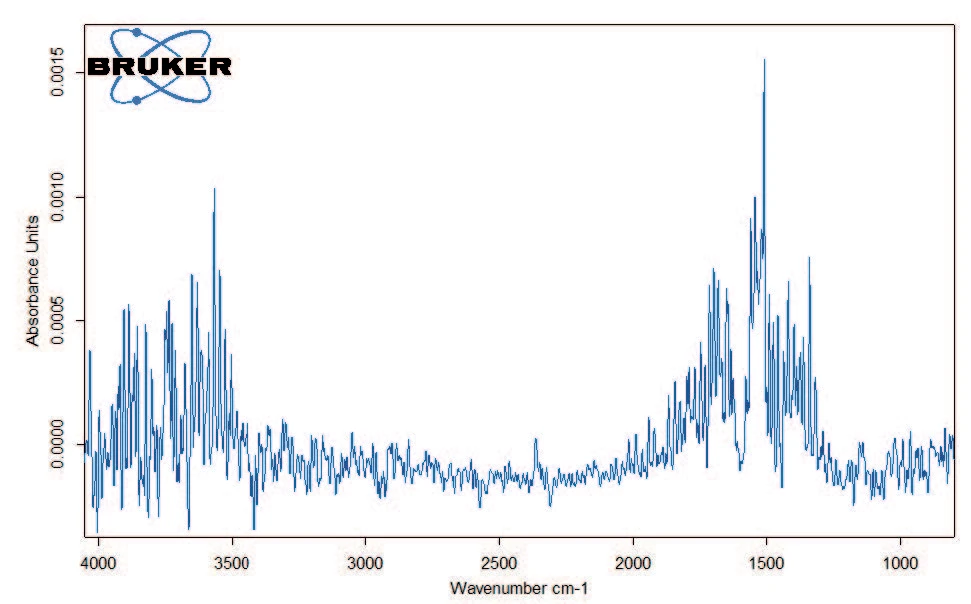
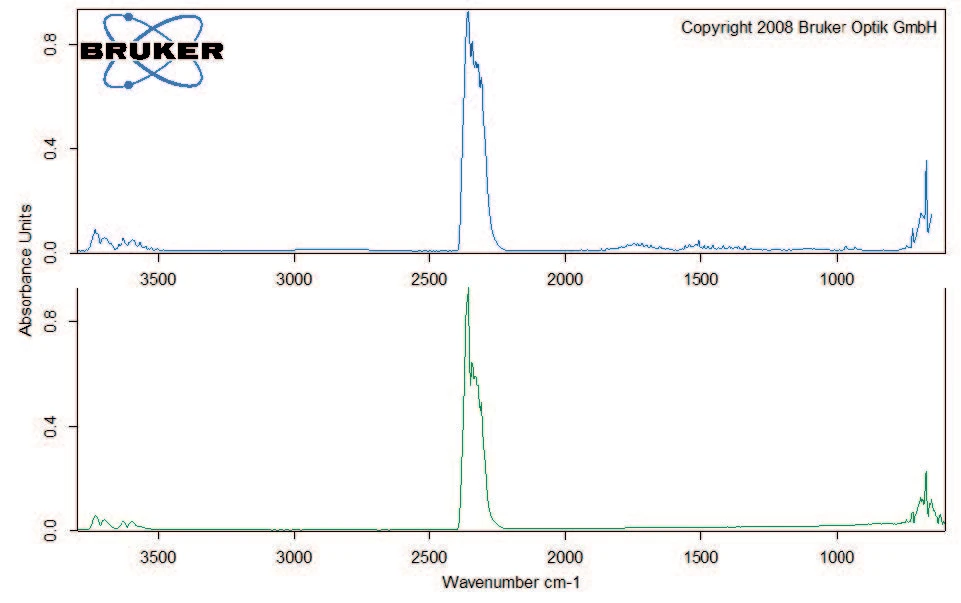
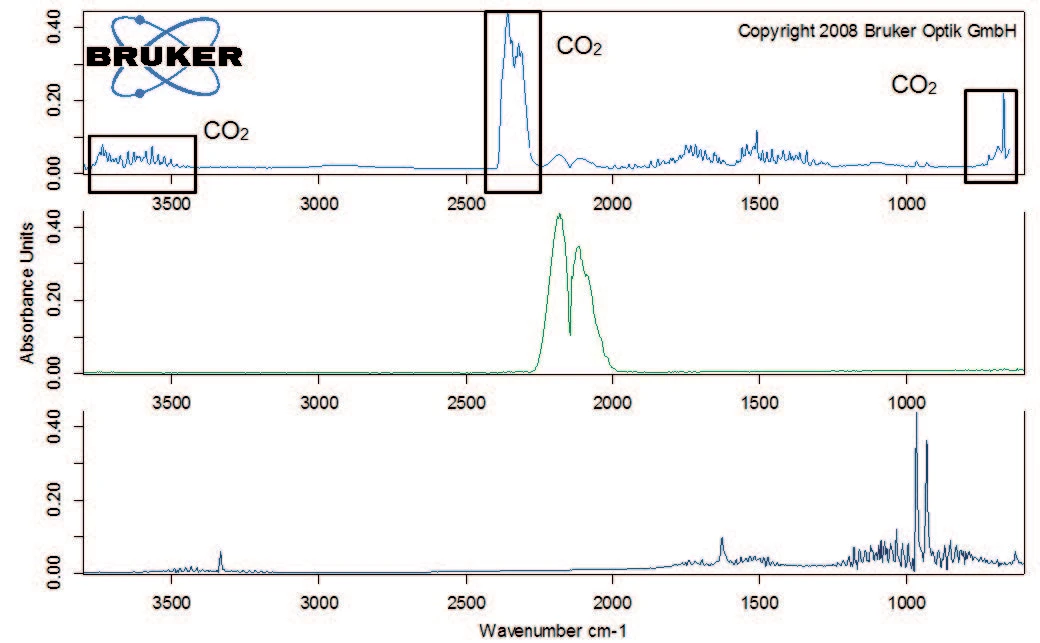
Abbildung 2 zeigt die TG-Kurve im gemessenen Temperaturbereich. Der erste Massenverlust von 1,5 %, der zwischen Raumtemperatur und 110 °C auftritt, ist auf die Freisetzung von Wasser zurückzuführen, wie das FT-IR Spektrum bei 47 °C belegt (Abbildung 3). Die anschließende Massenverluststufe von 15,6 % zeigt die maximale Zersetzungsrate bei 186°C (DTG-Peak) und ist sehr steil abfallend. Dies ist ein Anzeichen für die schnelle Zersetzung von Kaliumclavulanat durch Freisetzung von Kohlendioxid (Abbildung 4).
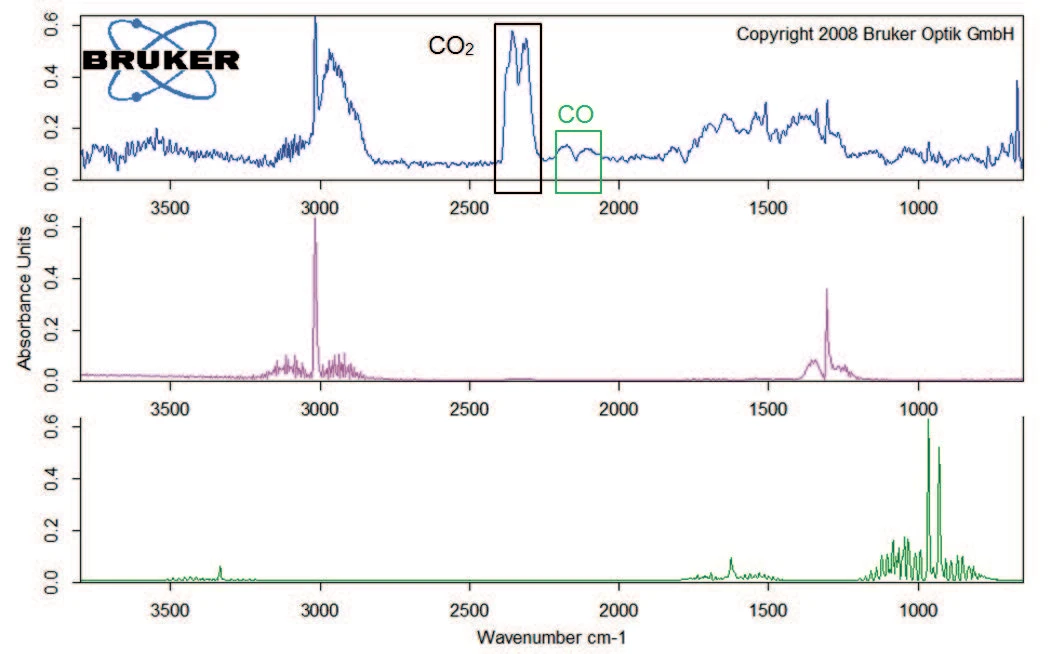
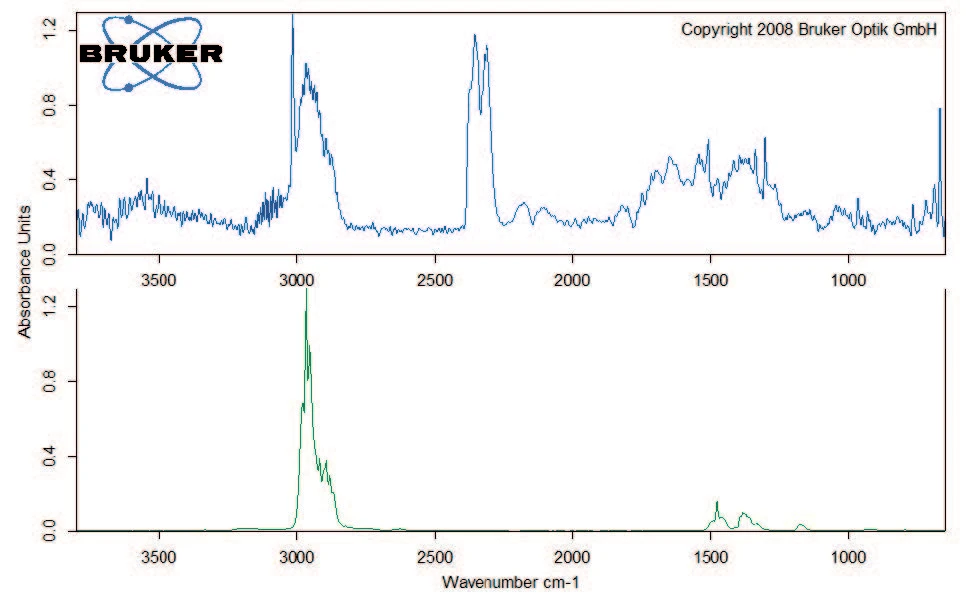
Die Zersetzung setzt sich mit einem Massenverlust von 40 % zwischen 200 °C und 400 °C fort. Neben Kohlendioxid beinhaltet die Gasphase auch Kohlenmonoxid (Wellenzahlenbereich 2000 cm-1 bis 2200 cm-1) und Ammoniak (Doppelband-Struktur bei ca. 950 cm-1) bei 329 °C (Abbildung 5). Des weiteren verliert die Probe 8 % an Masse mit steigender Temperatur bis 600 °C. Neben der Freisetzung von Kohlendioxid, Kohlenmonoxid und Ammoniak liegen in dieser Massenverluststufe auch die charakteristischen Absorptionsbanden für Methan und Isobutan vor (Abbildungen 6 und 7).
Zusammenfassung
Zunächst führt die Aufheizung von Kaliumclavulanat bis 600 °C zur Freisetzung von Oberflächenwasser. Danach zersetzt sich die Substanz in mehreren Stufen, beginnend mit der Freisetzung von Kohlendioxid und dann zusätzlich von Kohlenmonoxid und Ammoniak. In der letzten Massenverluststufe zwischen 400 °C und 600 °C werden auch Methan und Isobutan abgespalten.
Zur Untersuchung der Stabilität von Arzneimitteln eignet sich hervorragend die Kopplung der beiden Techniken Thermogravimetrie und FT-IR-Spektroskopie. Die Thermogravimetrie erfasst das Zersetzungsverhalten unter unterschiedlichen Atmosphären und Temperaturbereichen. Die bei der Aufheizung freigesetzten Gase werden über ein beheiztes Transfersystem in die Gaszelle des FT-IR-Systems geleitet und simultan zum Massenverlust detektiert. Damit entsteht ein tiefer Einblick in das Stabilitätsverhalten von Arzneimitteln. Durch die Kopplung der beiden Systeme wirken gleichzeitig zwei Methoden auf ein und dieselbe Probe, die damit unter denselben Bedingungen untersucht werden kann. Durch das Zusammenspiel der beiden Softwarepakete lassen sich die aufgezeichneten Massenverluste den freigesetzten Gasen einfach zuordnen.