Einleitung
Viele pharmazeutische Feststoffe weisen PolymorphiePolymorphie ist die Fähigkeit eines festen Materials, verschiedene kristalline Strukturen (Synonym: Formen, Modifikationen) auszubilden.Polymorphie auf, d.h. die Fähigkeit einer Substanz in unterschiedlichen kristallinen Formen zu existieren; sie besitzen damit eine unterschiedliche Anordnung der Moleküle im Kristallgitter. Polymorphe können aufgrund ihrer strukturellen Unterschiede unterschiedliche Festkörpereigenschaften aufweisen, z.B. DichteDie Massen-Dichte ist definiert als Verhältnis zwischen Masse und Volumen.Dichte, Farbe, Schmelzpunkt, Löslichkeit, mechanische Eigenschaften usw. Folglich kann die polymorphe Form tiefgreifende Auswirkungen auf die pharmazeutische Verarbeitung haben und z.B. einen Einfluss auf das Mahlen, Granulieren und Tablettieren nehmen [1].
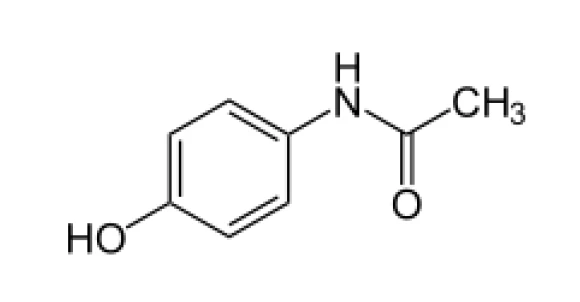
Paracetamol, das zur Behandlung von Schmerzen und Fieber eingesetzt wird, existiert ebenfalls in unterschiedlichen kristallinen Formen. Jede dieser Modifikationen weist ein anderes Verhalten auf, insbesondere, was die thermodynamische Stabilität und Kompressionsfähigkeit betrifft. Letztere Eigenschaft beeinflusst die Tablettierbarkeit dieses Arzneimittels, d.h. die Fähigkeit, unter Druck in eine Tablette gepresst zu werden.
Orthorhombisches Paracetamol (auch Form II genannt) kann nachweislich zur direkten Kompression verwendet werden. Die bessere Tablettierbarkeit als die der monoklinen Form von Paracetamol (Form I) ist auf das Vorkommen paralleler Gleitebenen in der orthorhombischen Struktur zurückzuführen [5, 6].
Die monokline Form ist jedoch – wahrscheinlich aufgrund ihrer besseren thermodynamischen Stabilität – die am häufigsten kommerzielle Kristallstruktur [4].
Da die Modifikation von Paracetamol eng mit seinen Eigenschaften verbunden ist, ist es wichtig zu wissen, in welcher Form es vor der Verarbeitung vorliegt, insbesondere bei der Herstellung von Tabletten, die kompaktiert werden müssen. Im Folgenden wird die Modifikation von Paracetamol mittels dynamischer Differenz-Kalorimetrie untersucht.
Messbedingungen
Die Messung an 1.69 mg Paracetamol wurde in einem kaltverschweißten Aluminiumtiegel mit gelochtem Deckel durchgeführt. In zwei Aufheizzyklen wurde die Probe jeweils auf 200 °C mit einer Heizrate von 10 K/min gefahren. Zwischen den beiden Aufheizzyklen wurde sie mit einer geregelten Rate von 10 K/min abgekühlt.
Messergebnisse
Abbildung 2 stellt die Messkurven der beiden Aufheizzyklen dar. Der während der ersten Aufheizung (grüne Kurve) bei 169 °C detektierte Peak (Onsettemperatur) stimmt sehr gut mit dem Schmelzpunktwert der kristallinen Modifikation (siehe Tabelle 1) überein.
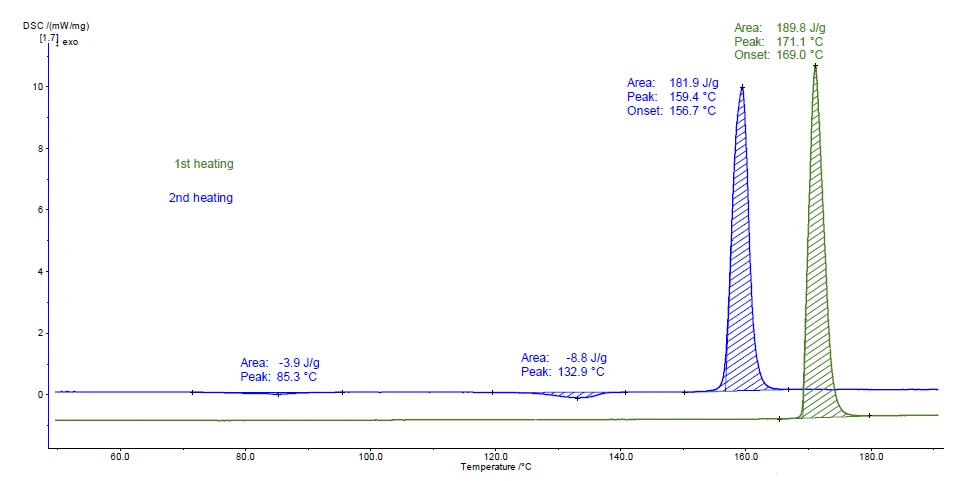
Tabelle 1: Schmelztemperaturen und SchmelzenthalpienDie Schmelzenthalpie einer Substanz, auch bekannt als latente Wärme, stellt ein Maß der Energiezufuhr dar, typischerweise Wärme, welche notwendig ist, um eine Substanz vom festen in den flüssigen Zustand zu überführen. Der Schmelzpunkt einer Substanz ist die Temperatur, bei der die Substanz von einem festen (kristallinen) in den flüssigen Zustand (isotrope Schmelze) übergeht.Schmelztemperatur der verschiedenen Modifikationen von Paracetamol [2, 3]
Die in der zweiten Aufheizung auftretenden exothermen Peaks bei 85 °C und 133 °C (Peaktemperatur) sind ein Anzeichen für die KristallisationAls Kristallisation bezeichnet man den physikalischen Vorgang der Verhärtung bei der Bildung und beim Wachstum von Kristallen. Bei diesem Prozess wird Kristallisationswärme frei.Kristallisation. Die gebildete Modifikation schmilzt anschließend bei 156,7 °C (Onsettemperatur), was charakteristisch für die kristalline Form II ist.
Zusammenfassung
Festkörpercharakterisierung ist für die Pharmaindustrie von zentraler Bedeutung, da Arzneimittel vorwiegend als Feststoffe hergestellt werden. Die Auswahl der optimalen festen Form ist ein kritischer Aspekt bei der Entwicklung von Arzneimitteln, da sie in mehr als einer Form oder Kristallstruktur (Polymorphismus) existieren können. Diese Polymorphe zeigen unterschiedliche physikalische Eigenschaften, die nicht nur ihre biopharmazeutischen Eigenschaften sondern auch ihre Tablettierbarkeit erheblich beeinflussen.
Mit nur einer einzigen DSC-Messung lässt sich die Schmelztemperatur für die Identifizierung der Modifikation der untersuchten Paracetamol-Probe bestimmen und erlaubt somit die Einschätzung ihres Verhaltens unter Kompression.