Einleitung
Laktose ist ein Disaccharidzucker aus Galaktose und Glukose, der in der Milch von Säugetieren vorkommt. Laktose macht etwa 2 bis 8 % der Milch (nach Gewicht) aus, wobei die Menge je nach Art und Individuum variiert. Der Name kommt von lac (gen. lactis), dem lateinischen Wort für Milch, und der Endung -ose für Zucker [2].
Laktose kann in amorpher oder kristalliner Form vorliegen. In der Milch findet man sowohl die α- als auch die ß-kristalline Form. Beide Formen unterscheiden sich in der Orientierung einer Hydroxylgruppe des Kohlenstoffrings. α-Laktose kristallisiert als Monohydrat, während ß-Laktose kein Kristallwasser enthält, weshalb sie oft als wasserfreie Laktose bezeichnet wird. Amorphe Laktose entsteht bei schneller Trocknung von hochkonzentrierter Laktoselösung [3].
Alle diese Formen von Laktose werden als Hilfsstoffe in pharmazeutischen Produkten verwendet. Jeder von ihnen hat jedoch physikalische Eigenschaften, die sich stark von den beiden anderen unterscheiden; sie werden daher jeweils für unterschiedliche Zwecke verwendet [3].
Messbedingungen
Die Messungen wurde mit der TG 209 F1 Libra® unter Stickstoffatmosphäre durchgeführt. Eine Laktoseprobe (Ausgangsmasse: 6,43 mg) wurde in einen offenen Aluminiumoxidtiegel platziert und von Raumtemperatur bis 500 °C mit einer Heizrate von 10 K/min aufgeheizt. Die während der Aufheizung freigesetzten Gase wurden direkt in die Gaszelle des FT-IR Spektrometers von Bruker Optik GmbH überführt.
Messergebnisse
In Abbildung 2 sind die Massenverlustkurve sowie deren erste Ableitung (DTG) dargestellt. Die Gram-Schmidt-Kurve gibt den Verlauf der mittels FT-IR detektierten freigesetzten Substanzen während der Aufheizung wider.
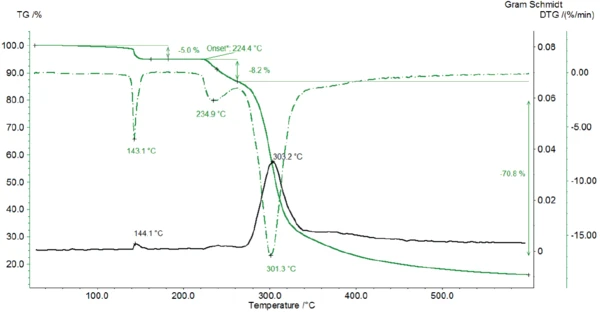
In einer ersten Massenverluststufe mit DTG-Peak bei 143 °C verliert die Probe 5 % ihrer Ausgangsmasse. Laktose hat eine Molmasse von 342,3 g/mol [2]. Im Laktose-Monohydrat ist jedes Laktose-Molekül mit einem Wassermolekül verbunden, was eine Molmasse von 360,3 g/mol ergibt. Das entspricht einem Massenverlust von 5 % nach der vollständigen Freisetzung des Kristallwassers.
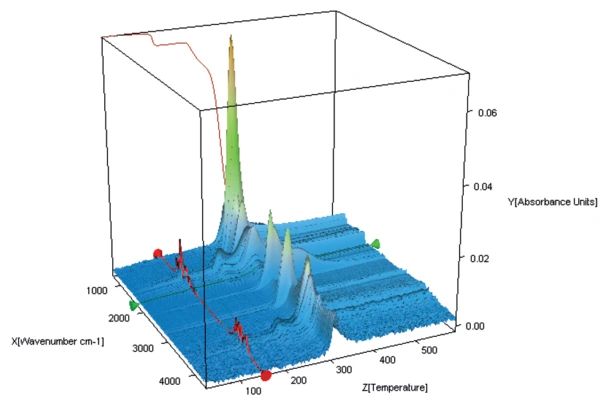
Abbildung 3 zeigt das 3-dimensionale FT-IR-Spektrum der während der Aufheizung freigesetzten Substanzen. Das Spektrum der bei 147 °C freigesetzten Produkte (Abbildung 4, oberes Spektrum) belegt, dass bei dieser Temperatur nur das enthaltene Kristallwasser verdampft. Zusammen mit dem zuvor diskutierten Massenverlust von 5 % bestätigt dies auch, dass es sich bei der untersuchten Laktoseprobe um ein Monohydrat handelt.
Die Zersetzung des Laktose-Monohydrats beginnt bei 224 °C (Onsettemperatur der TG-Kurve). Der Vorgang verläuft in 2 Stufen, wie den beiden Peaks in der DTGKurve zu entnehmen ist. Die erste der beiden Massenverluststufen von 8 % ist mit einem erneuten Wasserverlust verbunden (Abbildung 4, Spektrum in der Mitte), der auf die Zersetzung zurückzuführen ist.
Die zweite der beiden Zersetzungsstufen tritt bei 301 °C (DTG-Peak) mit einem Massenverlust von 71 % auf. Abbildung 5 zeigt das Spektrum der bei 309 °C (oben) mittels FT-IR-Detektor detektierten Substanzen. Der Vergleich mit den Bibliotheksspektren macht deutlich, dass sich Laktose zersetzt: Der Strukturring wird aufgebrochen, was durch die Freisetzung von Kohlendioxid und vermutlich Ethandiol erkennbar ist.
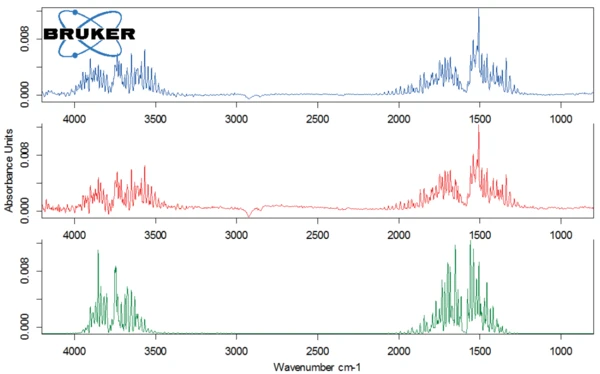
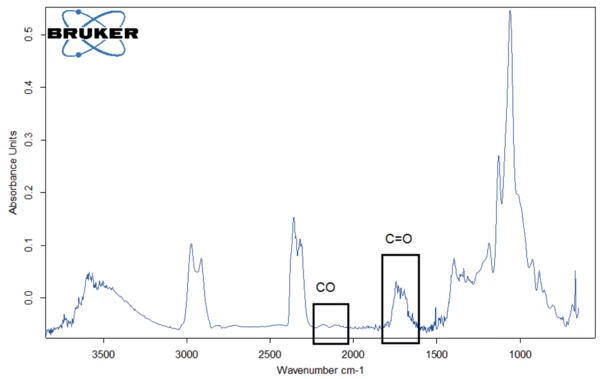
Für einen besseren Nachweis von weiteren freigesetzten Substanzen wurde das FT-IR-Bibliotheksspektrum von Wasser von dem bei 309 °C gemessenen FT-IR-Spektrum abgezogen (Abbildung 6). Auf diese Weise ließen sich Kohlenmonoxid sowie C=O-Banden in den freigesetzten Gasen identifizieren.
Zusammenfassung
Eine einzige Messung mit dem TG-FT-IR genügte, um eine Vielzahl von Informationen über die vorliegende Laktoseprobe zu erhalten. Es konnte bestätigt werden, dass es sich um ein Monohydrat handelt. Zusätzlich war es möglich, das Zersetzungsverhalten mit Beginn, Verlauf und Ende mit den jeweiligen Massenverlusten zu bestimmen. Der Zersetzungsverlauf kann mittels gekoppelter FT-IR Messung durch Identifizierung der freigesetzten Gase näher charakterisiert werden. Ein eindeutige Zuordnung von Wasser, Kohlendioxid, Kohlenmonoxid, Ethandiol und ein Produkt mit einer C=O-Bindung wird durch den Vergleich mit Bibliotheksspektren relativ einfach möglich.