Einleitung
Die Erforschung innovativer Batteriematerialien ist ein dynamisches Gebiet, getrieben von der Notwendigkeit, alternative oder ergänzende Lösungen für die derzeit dominierende Technologie, d.h. Lithium-Ionen-Batterien, zu finden [1]. Da diese Technologie hinsichtlich Nachhaltigkeit, Verfügbarkeit von Rohstoffen und Energie-/Leistungsfähigkeit an ihre Grenzen stößt, werden zur Lösung dieser Probleme kontinuierlich neue Materialien für Kathode, Anode und Elektrolyt vorgeschlagen. Thermoanalytische Techniken können die Forschung auf dem Gebiet der elektrochemischen Energiespeicherung gut unterstützen, wie bereits in früheren Application Notes aufgezeigt wurde. Bisher haben wir uns darauf konzentriert, Beispiele für die Standard-Lithium-Ionen-Batterietechnologie vorzustellen [2, 3, 4].
In dieser Application Note zeigen wir, wie diese Techniken auch Studien an neuartigen Batteriematerialien unterstützen können. Konkret wurden thermogravimetrische Analysen mit simultaner Kopplung eines Massenspektrometers (TG-MS) und der Fourier-Transformations- Infrarotspektroskopie (TG-FT-IR) an Molybdäntrioxid (MoO3)-Proben durchgeführt, die durch die Zugabe von Octylamin, einem organischen Molekül, in die Zwischenräume der Kristallstruktur modifiziert wurden mit einem Molverhältnis von MoO3:Octylamin 1:1 [5]. Octylamin wurde zugesetzt, um eine Kohlenstoffquelle in engem Kontakt mit MoO3 (Abbildung 1) zu schaffen.
Dieses anorganische Material wird als Kathodenmaterial eingesetzt, wobei Kohlenstoff durch die gute Elektronenleitfähigkeit als Beschleuniger der elektrochemischen Reaktionen wirkt. Daher ist Kohlenstoff vorteilhaft, um mit Schichtoxiden wie MoO3, die oft Halbleiter oder Isolatoren sind, eine hohe Performence zu erzielen. Nach Einbringen des organischen Moleküls wird das modifizierte Material (MoOx-OA) einem Pyrolyseprozess unterzogen; der Einsatz von TG-MS und TG-FT-IR war notwendig, um die Änderungen des Materials während dieser Behandlung zu untersuchen. Ziel ist es insbesondere zu verstehen, ob sich während der Pyrolyse Kohlenstoff bildet und ob diese Kohlenstoffbildung die Molybdänoxidstruktur beeinflusst.
Messbedingungen
Es wurden TG-MS- und TG-FT-IR-Analysen mit einer NETZSCH TG 209 F1 Libra® unter Argon mit einer Heizrate von 10 K/min von 40 °C bis 700 °C in offenen Al2O3- Tiegeln mit etwa 20 mg Probenmaterial durchgeführt. Die massenspektrometrischen (MS) Daten wurden mit einem QMS 403 Aëolos® Quadro Massenspektrometer im Bereich von 10 - 300 m/z erhalten. Zusätzlich wurden Fourier-Transform-Infrarot-Spektren (FT-IR) mit einem BRUKER INVENIO-Spektrometer im Absorptionsmodus im Wellenzahlenbereich von 4500 bis 650 cm-1 mit einer Auflösung von 4 cm-1 aufgenommen.
Messergebnisse
Die Ergebnisse deuten darauf hin, dass MoOx-OA während der Pyrolyse drei bedeutende strukturelle Übergänge durchläuft. Diese Übergänge können durch die Analyse der entstehenden gasförmigen Produkte mittels TG-MS und TG-FT-IR bei verschiedenen Temperaturen umfassend aufgeklärt werden.
In einer ersten Phase zwischen 120 °C und 200 °C (gelb in Abbildung 2) zeigen die thermogravimetrischen Ergebnisse einen zweistufigen Massenverlust von etwa 24 Gew.-%, der mit der Freisetzung gasförmiger Spezies einhergeht. Die Signale bei m/z = 17 und 18 in den TG-MS-Ergebnissen deuten auf die Desorption von Oberflächenwassermolekülen und Ammoniak (NH3) hin, die möglicherweise aus der Zersetzung von Octylamin stammen. Die Signale mit m/z = 30 entsprechen dem Ion [CH2NH2]+, was auf eine Ionisierung von Octylamin hindeutet. Außerdem kann m/z = 28 Kohlenwasserstoffen, CO2 oder N2 und m/z = 44 Kohlenwasserstoffen oder CO2 zugeordnet werden. Die TG-FT-IR-Ergebnisse in Abbildung 3 zeigen die Freisetzung von molekularem Octylamin und Wasser zusammen mit Spuren von CO2 und NH3 in diesem Temperaturbereich (siehe auch Abbildung 4a). Daher sind die Hauptursachen für die anfängliche Schrumpfung der Zwischenschichtabstände der Verlust von lose gebundenem Octylamin und Wasser durch VerdampfungVerdampfung beschreibt die Phasenumwandlung eines Stoffes von der flüssigen in die gasförmige Phase. Beim Verdampfen eines Stoffes unterscheidet man grundsätzlich zwei Formen, Sieden und Verdunstung.Verdampfung sowie die beginnende Zersetzung von Octylamin.
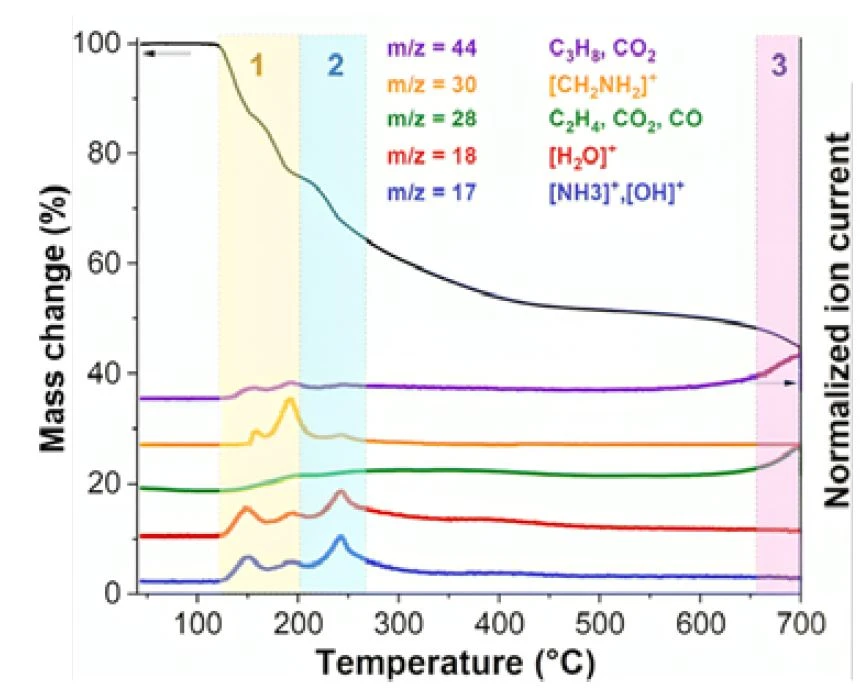


Eine zweite Phase bis 350 °C (hellblau in Abbildung 2) ist durch einen akkumulierten Massenverlust von etwa 43 Gew.-% gekennzeichnet, der mittels TG nachgewiesen wurde und gleichzeitig von MS-Signalen bei m/z = 17, 18 und 44 begleitet wird. Dies deutet auf eine weitere Freisetzung von Wasser und Octylamin-Zersetzungsprodukten (NH3 und Kohlenwasserstofffragmente) hin. Die FT-IR Spektren im Wellenzahlenbereich 3000 - 2800 cm-1 bestätigen die Bildung von Kohlenwasserstoffen, während die mehrdeutigen Absorptionsbanden im Bereich 1500 - 650 cm-1 die Zuordnung zu einem bestimmten Molekül verhindert (Abbildung 4b). Starke Ammoniak-Absorptionsmuster im gleichen Temperaturbereich bestätigen die Zersetzung von Octylamin. In der Endphase (violett in Abbildung 2) wird ein Massenverlust oberhalb von etwa 650 °C mit einem kumulativen Massenverlust von 58 Gew.-% beobachtet. Dies entspricht einem MS-Signal bei m/z = 44, das auf CO2 und eine carbothermische Reduktion von MoO3 zu MoO2 hinweist, die durch den PyrolysekohlenstoffBei Pyrolysekohlenstoff handelt es sich um den Kohlenstoff, der durch thermische Zersetzung vor organischen Materialen in sauerstofffreier Atmosphäre entsteht.Pyrolysekohlenstoff aus der Octylaminzersetzung verursacht wird. Ein weiteres signifikantes Signal bei m/z = 28 kann sowohl CO2 als auch CO zugeordnet werden, und die FT-IR-Spektren bei dieser Temperatur bestätigen das gleichzeitige Vorhandensein dieser beiden Gase (Abbildungen 3 und 4c).
Fazit
Zusammenfassend kann festgestellt werden, dass vor der Umwandlung in elementaren Kohlenstoff bestimmte Anteile von lose gebundenem molekularen Octylamin und seiner Zersetzungsprodukte aus dem Zwischenschichtraum während des Aufheizvorgangs freigesetzt werden. Darüber hinaus findet oberhalb von 650 °C eine ausgeprägte carbothermische Reduktion des Oxids statt, die die Struktur des Molybdänoxids verändert, indem Sauerstoff aus der Struktur entfernt wird. Die Entstehung von Kohlenstoff nach der Pyrolyse bestätigt sich, jedoch wurde durch die Verdampfung/Zersetzung eines Teils des Octylamins ein wesentlicher Teil dieser Kohlenstoffquelle entfernt. Künftige Bemühungen zur Verbesserung der Syntheseroute könnten sich daher vorrangig auf die Verwendung stärker gebundener und/oder weniger flüchtiger organischer Moleküle konzentrieren, da ein größerer Anteil von Kohlenstoff die elektrochemische Leistung des Batteriekathodenmaterials verbessern kann. Dennoch schneidet das resultierende Material nach der Pyrolyse als Batteriekathode besser ab als die MoO3- Referenzprobe in Bezug auf die bei hohen Strömen erreichte Kapazität und die Stabilität der Batterie selbst.
Die Kombination von TG-MS und TG-FT-IR war notwendig, um die Bildung der freigesetzten Gase in den verschiedenen Phasen der Pyrolysereaktion zu identifizieren und/oder zu bestätigen.